Planta para la recuperación del dióxido de carbono de los gases de combustión

Proyecto para la captación del 98% del CO2 producido en una planta industrial de cogeneración para su posterior purificación y venta
Necesidad del control de las emisiones de CO2
El calentamiento global de la Tierra como consecuencia del aumento de la concentración del dióxido de carbono y de otros gases en la atmósfera es posiblemente la cuestión ambiental más importante que afronta el mundo actual-mente.
En el conjunto de la Tierra se produce un efecto natural de retención del calor como ocurre en un invernadero, gracias a algunos gases atmosféricos. Se le llama efecto invernadero por similitud de efectos térmicos, porque en realidad la acción física por la que se produce es muy distinta a la que sucede en el invernadero de plantas. El efecto invernadero hace que la temperatura media de la superficie de la Tierra sea 33 ºC mayor que la que tendría si no existieran gases con efecto invernadero en la atmósfera. Dicho efecto se origina porque la energía que llega del Sol, al proceder de un cuerpo de muy elevada temperatura, está formada por ondas de frecuencias altas que traspasan la atmósfera con gran facilidad. La energía remitida hacia el exterior, desde la Tierra, al proceder de un cuerpo mucho más frío, está en forma de ondas de frecuencias más bajas, “absorbible” por los gases con efecto invernadero. Esta retención de la energía hace que la temperatura sea más alta. En condiciones normales, la cantidad de energía que llega a la Tierra es la misma que la que ésta emite, ya que de no ser así la temperatura de nuestro planeta habría ido aumentando continuamente. Lo que el efecto invernadero consigue es ralentizar la emisión de la energía que llega a la Tierra, y reducir los bruscos cambios de temperatura de la superficie terrestre entre el día y la noche, haciendo posible la vida en nuestro planeta.
El desequilibrio se produce al aumentar de forma desmedida la concentración de gases con efecto invernadero en la atmósfera. La concentración media de CO2 se ha incrementado desde unas 275 ppm antes de la revolución industrial, a 315 ppm cuando se empezaron a usar las primeras estaciones de medida exactas en 1958, llegando hasta 361 ppm en 1996. A partir de 1979, los científicos comenzaron a afirmar que un aumento al doble en la concentración del CO2 en la atmósfera supondría un calentamiento medio de la superficie de la Tierra de entre 1,5 y 4,5 ºC, si bien estudios más recientes sugieren que el calentamiento se produciría más rápidamente sobre tierra firme que sobre los mares.
Aparte del CO2, existen en la atmósfera otros gases con efecto invernadero, como el CH4, con una acción 25 veces superior al CO2, y los CFCs, 15 000 veces más activos que el CO2. No obstante, como la cantidad de CO2 es mucho mayor que la del resto de los gases, su contribución real al efecto invernadero es del 76% respecto al total de gases. El oxígeno y el nitrógeno, aunque se encuentran en proporciones mucho mayores, no son capaces de generar efecto invernadero.
La industria es responsable, directa o indirectamente, del 55-80% de la producción de CO2, entre otros gases, y una fracción apreciable de las emisiones ocurre como resultado de actividades industriales relacionadas con la combustión de combustibles fósiles. En el caso más general, al quemar un combustible fósil cuya composición química contiene los elementos C, H, O, N y S, se puede aplicar el siguiente esquema: 
En una combustión típica se pueden producir más de 100 especies químicas diferentes. El grupo de gases indicado por (A) corresponde al grupo que aparece con mayor frecuencia y concentración. Los grupos (B) y (C) aparecen en condiciones de exceso o defecto de oxígeno, y de acuerdo con la calidad de la combustión. Aunque la concentración de los gases de los grupos (B) y (C) es menor comparado con los del grupo (A), no por ello son menos importantes, ya que entre ellos están el CH4 y el N2O, con efecto invernadero superior al CO2.
En la Cumbre Mundial del Clima de Kioto en diciembre de 1997, se reconoció oficialmente la gravedad del problema por parte de todos los países industrializados, pero las reducciones acordadas de emisiones de gases invernadero (especialmente CO2) fueron relativamente escasas. Así pues, en Kioto se acordó reducir en Europa un 8%, EEUU, el país más contaminante, un 7% y Japón un 6%, entre 2008 y 2012, mientras que una consideración científica indicó que para obtener una corrección real del efecto invernadero en la Tierra se debería reducir, como mínimo, un 46% para el año 2010 en los países industrializados.
Diversas organizaciones internacionales como Convención de Marco de Naciones Unidas sobre el Cambio de Clima (UNFCCC), y el Panel Intergubernamental sobre el Cambio de Clima (IPCC) han sido formadas para dirigir el tema de la reducción del efecto invernadero. Están siendo exploradas tres opciones para estabilizar los niveles atmosféricos de gases invernaderos: (1) mejoras en eficiencia en el proceso de combustión, conversión energética, etc.; (2) empleo de combustibles cuyos productos de combustión tengan una proporción de CO2/H2O más baja; y (3) captura y recuperación del CO2 procedente de los gases de combustión, antes de que sean liberados a la atmósfera, utilizando sustancias químicas y sistemas físicos o biológicos. La aplicación desarrollada en este trabajo corresponde a la tercera opción, que es de tipo correctivo, mientras que las opciones (1) y (2) son de tipo preventivo.
El mercado del CO2 recuperado
El dióxido de carbono, CO2, es un gas incoloro con leve olor penetrante y gusto ácido, reconocido por primera vez en el siglo XVI como un gas diferente al observarse como subproducto en la combustión y fermentación del carbón de leña. Hoy en día, el CO2 es un subproducto de muchos procesos industriales: producción de amoníaco sintético, producción de hidrógeno, fermentación y síntesis de ciertos productos químicos con presencia de monóxido de carbono. Sus aplicaciones son muchas y muy variadas, y se pueden diferenciar según el estado en que se encuentra el gas, como se detalla a continuación.
CO2 gas
Una gran proporción (aprox. 50%) de todo el CO2 recuperado se utiliza en el punto de producción de productos químicos comerciales, principalmente urea y metanol. En estas aplicaciones el CO2 se utiliza en estado gaseoso, y sus propiedades químicas son de vital importancia. Una de las aplicaciones más importantes cerca del punto de producción es la de aumentar la recuperación de petróleo, aplicación desarrollada en Estados Unidos. El resto de CO2 se utiliza en forma líquida o sólida.
CO2 líquido
Los usos del CO2 en estado líquido son los más variados. Previamente a la licuefacción del CO2, éste se ha de purificar. Se utiliza carbón activo para eliminar olores y sabores. También es importante el secado del gas, mediante alúmina activada o gel de sílice. La temperatura crítica es de 31 ºC y la presión crítica 7,4 MPa, por lo que debe ser licuado a cualquier temperatura entre 31 ºC y su punto triple (-56,6 ºC).
Una aplicación extendida del CO2 es la obtención de atmósferas inertes. En el manejo y transporte de alimentos envasados, la perdida de aroma o el crecimiento de bacterias se puede prevenir mediante el uso de CO2: embotellado y transporte de cerveza, empaquetado de café, transporte de frutas, vegetales y cere-ales son claros ejemplos donde, además, la naturaleza no tóxica del CO2 es obviamente muy importante, compitiendo con el nitrógeno en esta aplicación.
El CO2 es muy útil en la extinción de incendios porque es más pesado que el aire y extremadamente estable. Puede ser utilizado en aquellos fuegos en los que el agua no sea eficaz, por ejemplo en los de origen eléctrico. Dado que no es tóxico y se evapora sin dejar residuo, no daña ni contamina los materiales sobre los que actúa.
También se utiliza como gas de protección de soldaduras, cuya función es proteger la zona a soldar del ataque del oxígeno, nitrógeno e hidrógeno. Pocos gases poseen este efecto escudo, y las alternativas al CO2 (gases nobles, principalmente Ar) son más caras.
Una aplicación derivada de su acción en la naturaleza es la mejora del crecimiento de las plantas, seguida sobre todo en el Reino Unido y Holanda por los agricultores de frutas y verduras. Introducen el gas en sus invernaderos para aumentar los niveles que normalmente se encuentran en el aire (por ejemplo, 100 mg/kg comparado con 300 mg/kg). Las plantas responden asimilando una mayor cantidad de CO2 con aumentos del rendimiento de hasta un 15%.
El CO2 se utiliza también en ciertos reactores nucleares como medio de transferencia de calor intermedio, y como refrigerante del reactor, mientras genera vapor para producir electricidad. Es útil en este tipo de aplicaciones porque no se vuelve significativamente radioactivo y se puede disponer en grandes cantidades.
El CO2 presenta una moderada solubilidad en agua, y se hace uso de esta propiedad en la producción de bebidas alcohólicas y no alcohólicas. Ésta fue la primera gran aplicación del CO2. La carbonatación de bebidas se lleva a cabo con CO2, para evitar la precipitación de compuestos de calcio insolubles.
El uso del CO2 en la industria del aerosol va aumentando estacionariamente. Esta aplicación depende de la solubilidad en el producto a ser administrado.
En el proceso silicato-dióxido de carbono para la producción de moldes fun-didos, se utiliza la reacción química entre el CO2 y la sílice para unir los granos de arena.
El silicato de sodio, uno de los intermedios en la producción de la aspirina, se obtiene de la reacción entre el CO2 y el fenolato sódico.
También se utiliza en la fabricación de carbonato de plomo básico, y en carbonatos de sodio, potasio y amonio. Y como agente neutralizante en operaciones de mercerización en la industria textil, con mejor resultado que el ácido sulfúrico.
Por último, el CO2 líquido se utiliza en la obtención de carbón, siendo alimentado a la mina para que la rápida expansión rompa el carbón. En la extracción a altas presiones de productos naturales se utiliza CO2 líquido como disolvente, para aislar aromas o fragancias particulares.
CO2 sólido
El rango de refrigeración del CO2 sólido se extiende hasta –78 ºC a presión atmosférica (se pueden conseguir temperaturas menores a presiones reducidas). Se usa el CO2 en estado sólido porque no deja ningún residuo al evaporar-se, no es pesado y puede ponerse en contacto directo con los alimentos. Sin embargo, después de la Segunda Guerra Mundial, los cambios en el diseño de los compresores y la posibilidad de disponer de temperaturas muy bajas hizo posible obtener CO2 en estado líquido a gran escala, y el CO2 en estado líquido empezó a sustituir al sólido en muchas aplicaciones. Los usos en los que aún esté favorecido en estado sólido son muy pocos, donde el peso es un factor importante, como en el transporte de alimentos refrigerados por carretera o aire.
Sistema de captura del CO2
Estudio de opciones técnicas
Existen varias opciones técnicas y económicamente viables para la captura y separación de CO2. Otras opciones están en vías de desarrollo tecnológico y se pueden considerar como tecnologías avanzadas de posible aplicación en el futuro. A continuación se describen los diferentes sistemas de captura de CO2 conocidos y la selección del que mejor se adapta a las condiciones requeridas. Los sistemas utilizados para la captura de CO2 son los siguientes:
- Absorción química en líquidos.
- Métodos criogénicos.
- Adsorción física en sólidos.
- Absorción física en líquidos.
- Separación mediante membranas selectivas.
Algunos de estos diferentes sistemas se han utilizado en la industria química y en la producción de gases para su posterior uso en industrias y en laboratorios. Algunas veces, se combinan dos o más de estos métodos para alcanzar un alto grado de separación del gas interesado de la mezcla. En nuestro caso, el objetivo es eliminar el CO2 de otros gases procedentes de la combustión, y conseguir una alta pureza para su posterior venta.
Métodos criogénicos
El CO2 puede ser condensado y separado de gases poco (o menos) condensables a bajas temperaturas y altas presiones. El proceso total consta de condensación y destilación criogénica (CDC). Los gases de combustión son secados y comprimidos a la entrada y el gas seco es refrigerado en una columna de condensación con objeto de recobrar el CO2 condensado. El método CDC ha sido empleado para la eliminación de CO2 en mezclas de CH4/CO2 y otros gases empleados en la recuperación de hidrocarburos de fuentes naturales. La eficiencia de control de una instalación CDC es de un 70% a 85%. Este proceso requiere un consumo elevado de energía cuando la concentración de CO2 en los gases de entrada es bajo, que es el caso que nos ocupa.
Adsorción física en sólidos
En la adsorción, el CO2 es retenido en el sólido debido a las interacciones con la superficie de las partículas y su porosidad. En estos procesos se trabaja en condiciones casi isotérmicas, y la operación consta de dos fases: la adsorción, que se realiza a alta presión, con objeto de que la presión parcial del gas al ser capturado sea elevada, y la recuperación, que se realiza a una presión menos elevada, para liberar y recuperar el CO2 adsorbido. Estos procesos de captura y recuperación de gas por adsorción tienen un gran interés técnico, económico y comercial. La captura y recuperación de CO2 de los gases de combustión puede llevarse a cabo por procesos de adsorción en sólidos químicamente reactivos y no reactivos. El proceso. Los adsorbentes sólidos que debieran ser considerados para la absorción del CO2 son adsorbentes naturales como yesos y zeolitas; aceite bituminoso de desecho; adsorbentes procesados como sílice, zeolitas y tamices moleculares; y por último el carbón, el lignito y la antracita.
Separación mediante membranas selectivas
La difusión de gases de distintos tamaños moleculares se puede llevar a cabo por mediación de membranas. Este método evita la necesidad de cambios de fase. Las membranas para la absorción de gases constan de un líquido de absorción en contacto con un lado de una membrana porosa con objeto de proveer una gran superficie de contacto y evitar mezclar el gas con el líquido. La separación se basa en la distinta velocidad de difusión de diferentes gases. El CO2, siendo una molécula triatómica, puede separarse con relativa facilidad de moléculas diatómicas como O2 y N2.
Las membranas para la separación de gases pueden dividirse en dos tipos: membranas orgánicas y membranas inorgánicas. Membranas orgánicas apropiadas para la separación de CO2 de N2 incluyen materiales derivados de la celulosa, polisulfona, poliamidas y poliimidas. Las membranas no orgánicas son químicamente estables y apropiadas para operación a presión elevada, pero son más caras que las de tipo orgánico. Ejemplos de este tipo de membranas son las membranas porosas inorgánicas, como membranas cerámicas, membranas de óxidos metálicos y membranas inorgánicas no porosas, tales como membranas metálicas. Debido a que la diferencia de tamaño y masa de N2 y CO2 es pequeña, las membranas no orgánicas porosas no son adecuadas para la separación de CO2 de gases de combustión.
En la configuración con una membrana, ésta separa los gases de combustión en un permeado rico en CO2 y una fracción pobre en CO2. La segunda es descomprimida en una cámara de expansión y liberada, subsecuentemente, a la atmósfera. El permeado rico en CO2 es comprimido a una presión de 8 MPa. El permeado obtenido en un sistema consistente de una membrana solamente produce un permeado rico en CO2 diluido con N2. Éste no es un resultado deseable, ya que el CO2 se condensará al ser comprimido, mientras que el N2 permanecerá en forma gaseosa.
Selección del sistema más adecuado: absorción química
El sistema debe ser compatible para corrientes de gases con concentraciones bajas de CO2; las corrientes de CO2 son bajas en las centrales eléctricas debido a que las turbinas de gas trabajan con proporciones muy altas de aire/combustible y el combustible utilizado es general-mente gas natural, que es el combustible que produce la fracción CO2 más pequeña. Esto excluye automáticamente el uso de membranas selectivas, porque su habilidad de separar un gas en una mezcla de gases se reduce considerablemente en concentraciones bajas, y además se requieren membranas muy grandes. Además, algunas membranas se deben utilizar en niveles bajos de temperatura, y esto no es posible en gases procedentes de centrales eléctricas, ya que éstos no se pueden refrescar a la temperatura ambiente ni menor.
La elevada temperatura de los gases de salida de las turbinas descarta también el uso de sistemas criogénicos. De hecho, los sistemas criogénicos son efectivos para gases almacenados en el ambiente, con temperaturas de los gases muy bajas, con una concentración alta del gas a separar y sin presencia de agua. Si no es bajo estas condiciones, existe la posibilidad de formación de hielo que dañaría la planta, y aumentaría el costo de ésta.
También se descartan los sistemas basados en la adsorción física, porque presentan problemas en gases con baja concentración de CO2.
Así pues, los dos sistemas restantes, basados en la absorción química y absorción física mediante un absorbente líquido, son las técnicas mejor definidas para la captura de CO2. Los sistemas químicos tienen la ventaja frente a los sistemas físicos en la captura de CO2 de que presentan un costo operacional más bajo. Además, el proceso de extracción, que sigue a la absorción, necesita menos energía para el caso de sistemas químicos. En conclusión, la absorción y extracción química es la técnica mejor considerada. En particular, el absorbedor más empleado para el CO2 en esta técnica es una solución de amina, monoetanolamina al 30% (MEA).
En la operación de absorción de gases, una mezcla gaseosa se pone en contacto con un líquido, a fin de disolver de manera selectiva uno o más componentes del gas y de obtener una solución de éstos en el líquido. Estas operaciones requieren la transferencia de masa de una sustancia en la corriente gaseosa al líquido. Esto se aplica cuando se quiere recuperar en un líquido componentes que acompañen el afluente gaseoso de un reactor, bien sea para conseguir su neutralización, o bien para evitar la contaminación del medio ambiente. La absorción de gases es una operación en la cual, cuando la transferencia de masa sucede en la dirección opuesta, es decir, del líquido al gas, la operación se conoce como desorción.
Muchos procesos industriales de absorción van acompañados de una reacción química. Aunque el proceso general se considera heterogéneo, la reacción química es realmente homogénea, y ocurre en la fase líquida, que es lo más común, en la fase gas o muy raramente en ambas fases simultáneamente. Algunas veces, tanto el reactivo como el producto de la reacción son solubles en el líquido, como en nuestro caso, en la absorción del CO2 en una solución acuosa de monoetanolamina (MEA).
La reacción entre el soluto absorbido y un reactivo produce dos hechos favorables a la rapidez de la absorción: el aumento de la capacidad de adsorción del líquido respecto al componente gaseoso, y el aumento de la velocidad global del proceso.
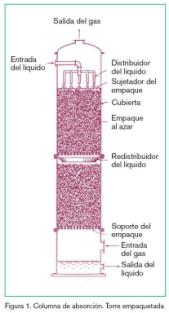
Las instalaciones utilizadas son las columnas de absorción con un lecho fijo de relleno, o torre empaquetada (figura 1).
Al existir el contacto directo entre el gas y el líquido, se puede beneficiar en el enfriamiento del gas caliente. En las torres empacadas y de aspersión en contracorriente, los fluidos están en contacto continuo durante su trayectoria a través de la torre. Por lo tanto, en una torre empacada las composiciones del líquido y del gas cambian continuamente con la altura del relleno. La caída de presión para la fase gaseosa es relativamente baja en comparación con otros tipos de torres, por lo que las torres de relleno son muy adecuadas para tratar caudales elevados de gas y en procesos de baja presión, y proporcionan una baja retención del líquido, lo cual es importante cuando el líquido se deteriora a altas temperaturas.
La desorción del CO2 para su recuperación tendrá lugar en una segunda torre, que también suele ser de relleno, en la que se aplicará calor para aumentar la temperatura de la disolución y disociar el compuesto del gas en solución, consiguiendo invertir el proceso de transferencia de materia, de líquido a gas.
Absorción química del CO2 con monoetanolamina (mea) y posterior desorción del CO2
Las soluciones acuosas de alcanolaminas primarias, secundarias y ternarias se utilizan ampliamente en la separación de gases ácidos, CO2, en procesos reversibles de absorción y regeneración. Las aminas primarias y secundarias, como la MEA y la DEA, respectivamente, son muy reactivas y por lo tanto presentan altas velocidades de eliminación de CO2. Sin embargo, la formación de carbamatos estables con el CO2 provoca una limitación de carga estequiométrica de 0,5 mol CO2/mol amina, aun en presiones parciales relativamente altas de CO2 en el gas. La gran estabilidad del carbamato formado a partir de CO2 y MEA dificulta mucho la operación de recuperación de CO2 de las soluciones acuosas de monoetanolamina. Las condiciones necesarias para poder realizar esta operación de extracción del CO2 son a una presión de 1,6 bar y una temperatura de 122 °C en la caldera, y de 1,4 bar y 104 °C en lo alto de la columna. Por lo tanto, se necesita un gran aporte de calor para la regeneración de la MEA. Este problema se puede solventar aprovechando el calor sensible de los gases para aumentar la temperatura de la MEA rica en la columna de extracción y también calentando la solución de la MEA rica antes de entrar en la columna de extracción aprovechando el calor sensible de la corriente de la solución de MEA pobre que sale de la columna de extracción, que además debe ser enfriada para volver a entrar en la columna de absorción. La figura 2, que se comenta más adelante, ilustra este procedimiento.
LA MEA tiene un grupo de hidroxilo (-OH) y un grupo de amino (-NH2). El grupo de hidroxilo sirve para reducir la presión de vapor y aumentar la solubilidad de agua, mientras el grupo de amino proporciona la alcalinidad necesaria para causar la absorción de gases ácidos.
Las reacciones principales que ocurren cuando soluciones de una amina primaria, tal como MEA, se utiliza para absorber CO2 se pueden representar de la siguiente manera: 
Como se puede observar, se utilizan 2 moles de MEA para capturar 1 mol de CO2.
La reacción mostrada en la ecuación (3) tiene como resultado la formación de la sal de amina de un sustituido ácido carbónico (carbamato), es directa y relativamente rápida. Las reacciones simbolizadas por ecuaciones (1) y (2) son lentas porque, antes de reaccionar con la amina, el CO2 debe reaccionar primero con agua para formar el ácido carbónico, y seguidamente reaccionar con la amina para formar el carbonato de monoetanolamina.
En cuanto a la regeneración, la reacción es reversible y se puede alterar el equilibrio variando la temperatura, las alcanolaminas tienen presiones de vapor apreciables bajo condiciones normales para que la composición de la solución del equilibrio varíe con la presión parcial de los gases ácidos sobre ellas. Cuando las presiones de vapor de estos recintos aumentan rápidamente con la temperatura es posible quitar los gases absorbidos en la solución por la aplicación del calor. Se absorbe CO2 a través de un medio de absorción en el intervalo de temperatura comprendido entre 20 y 70 ºC, y se libera desde la MEA en el intervalo de temperatura comprendido entre 120 y 150 ºC, desplazándose la reacción hacia la derecha.
Descripción del proceso propuesto
La planta de recuperación de CO2 objeto de este trabajo se ha planteado como anexa a una planta real de cogeneración eléctrica, con una potencia eléctrica instalada de 14 650 kW. La planta de cogeneración consta de 5 motores de mezcla pobre (combustión pobre), de 2 930 kW eléctricos cada uno, los cuales utilizan como combustible gas natural. Se considera que los motores, en condiciones de funcionamiento normales, emiten un caudal de 30,44 kg/s de gases a una temperatura elevada. De este caudal, aproximadamente un 8% corresponde al CO2.
La planta de recuperación de CO2 se compone básicamente de un conjunto de torres de lavado y extracción de CO2 mediante el proceso químico y térmico explicado más arriba. El gas de salida se enfría y comprime hasta que el CO2 se licua y puede ser almacenado en tanques. La capacidad de recuperación es de 2800 kg/h de CO2 líquido.
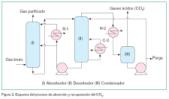
La figura 2 ilustra de forma esquematica la parte principal del proceso, descrito a continuación. El gas de combustión, acondicionado y lavado, se enfría primeramente en un depurador, desde los 208 ºC hasta los 32 ºC, en el que se añade carbonato de sodio con el fin de eliminar el dióxido de azufre. Una vez libre de azufre, los gases de combustión son conducidos a la torre de absorción o absorbedor (I) mediante una bomba soplante. En el absorbedor, el CO2 contenido en los gases de combustión es absorbido por la mezcla de MEA (30%) a contracorriente, y pasa mayoritariamente a la forma estable de carbamato (MEACOO–). Cuando los gases llegan a la parte superior de (I), se encuentran con una fase de lavado donde el agua y la MEA residual se recogen para ser enviadas de nuevo al absorbedor. El gas purificado se elimina a la atmósfera.
La mezcla de MEA saturada de CO2 (MEA rica) es bombeada a través de un intercambiador donde se precalienta, desde los 47 ºC hasta los 103 ºC, antes de ser conducida a la torre de extracción (II). Aquí, mediante un recalentamiento con vapor externo (C-2), se extrae el CO2. El vapor de MEA, el vapor de agua (generado por evaporación parcial de la solución acuosa en la torre) y el CO2 que salen de la caldera ascienden por la columna de extracción, entrando en una sección de lavado en la parte superior de la misma, en la que la MEA residual es eliminada de los gases. El gas CO2, de salida de la columna de extracción (75% CO2, 25% agua), se enfría en un intercambiador (R-2) en una primera etapa, y luego pasa a un enfriador-condensador(III) en una segunda etapa, pasando en conjunto desde los 97 ºC hasta los 32 ºC. En (III) se condensa la mayor parte del vapor de agua, que es bombeado hacia la sección de lavado situada en la parte superior del extractor (II), donde se elimina la niebla de MEA, mientras que el CO2 sigue su curso hacia la etapa de licuefacción.
La mezcla de MEA no saturada (MEA pobre) es bombeada desde el calderín de (II) a través del enfriador de mezcla, donde se enfría inicialmente calentando la mezcla de MEA saturada fría (MEA rica), desde los 121 ºC hasta los 40 ºC, proveniente del absorbedor (I), y después mediante un refrigerador (R-1), antes de dirigirse de vuelta hacia el absorbedor (I). Una parte de la MEA fría se recircula a través de un filtro de carbón, a fin de eliminar los contaminantes disueltos.
Otra parte de la MEA fría se extrae a intervalos y se dirige hacia un regenerador, en el cual los contaminantes, como las sales de nitrato térmicamente estables y otras cadenas de compuestos, son eliminados mediante un proceso de ebullición con vapor. En esta etapa se añaden anticorrosivos y antiespumantes a la solución de MEA regenerada.
Una cierta parte de agua de salida del enfriador (III) debe ser reintroducida en el regenerador (II) para diluir el vapor de MEA hasta una concentración mitad, a fin de mejorar la operación. De este modo, se reduce la temperatura requerida para la regeneración.
El CO2 de salida del enfriador de gas (III) es enviado a un depurador de KMnO4 (de alto poder oxidante), con el fin de extraer los óxidos de nitrógeno, las eventuales trazas de MEA y los productos de descomposición y aldehídos procedentes de la combustión. Posteriormente, el CO2 se comprime hasta 21 bares, mediante la acción de dos compresores de pistones libres de aceite, que estarán equipados con un sistema de pre y post refrigeración. Unos filtros coalescentes y de carbón activo serán los encargados de eliminar las partículas de aceite de los vapores hasta alcanzar un nivel mínimo que garantice la calidad alimentaria requerida para el CO2.
Con posterioridad, un secador absorberá el agua hasta que el dióxido de carbono presente un punto de rocío de -60 ºC (lo que equivale a un contenido de agua de 10 ppm). Este deshidratador se regenerará de forma automática mediante un calefactor externo de aire caliente. La refrigeración se llevará a cabo mediante un pequeño flujo de la purga de gas del condensador de CO2, que es reenviado hacia la entrada del absorbedor. Tras el deshidratador, el gas pasará por un filtro de carbón activo para extraer los aldehídos y, ocasionalmente, las sustancias aromáticas. La extracción posterior del oxígeno de la mezcla asegura una pureza final del CO2 próxima al 99,99%
El CO2 gas obtenido es dirigido hacia el intercambiador de la unidad de purificación, donde es refrigerado antes de que continúe hacia el condensador de CO2, donde la mayor parte del mismo condensa a una temperatura entre -25 ºC a -30 ºC. El CO2 ya condensado es almacenado en un tanque intermedio, de donde se bombeará a la parte superior de la torre de purificación. Desde el fondo del intercambiador, el CO2 más puro se subenfriará hasta -25 ºC antes de ser bombeado a los tanques de almacenamiento.
Presupuesto
En la tabla 1 se detalla el presupuesto para la instalación descrita, en lo que respecta a equipos principales, auxiliares, de servicios, y la instrumentación, así como el coste de la instalación y montaje. Se ha excluido el precio del terreno.
Tabla 1. 
A modo de ampliación, cabe indicar que el precio de salida del CO2 obtenido está entre 0,10 e/ kg y 0,19 e/ kg, máximo cuando se alcanza la máxima pureza (necesaria para la industria de la alimentación). No todo el CO2 vendido es para la alimentación, por lo que no necesita un grado de pureza tan alto y su precio es inferior. Si se toma el precio de salida en unos 0,14 e/kg (valor medio aproximado), y considerando que la producción es de 2800 kg/h, trabajando la planta en continuo prácticamente todo el año (por ser anexa a la planta de cogeneración), se puede prever un volumen bruto de ingresos anuales por ventas (V) de:
V = 2800 kg / h × 8400h / año × 0,14 A / kg = 3.292.800 C / año
Resumen
En este artículo se presenta el proyecto de una planta para la recuperación de CO2 de los gases de combustión de una instalación de cogeneración. Diariamente se genera un excedente de CO2 en la combustión de petróleo, carbón y/o gas natural en procesos industriales, y las centrales térmicas son responsables de un 30% de las emisiones de CO2 a la atmósfera. El CO2 emitido es el principal causante del aumento del efecto invernadero, uno de los mayores problemas medioambientales de nuestro planeta. En el trabajo que se presenta se prevé la captación del 98% del CO2 producido en una planta industrial de cogeneración con una potencia eléctrica instalada de 15 000 kW. Los gases de combustión, que están exentos prácticamente de compuestos de azufre, contienen un 7,7% de CO2. Este contenido es adecuado para su recuperación en columnas de absorción de gases, mediante un proceso de absorción química, y utilizando como absorbente la monoetanolamina (MEA), y en una segunda etapa se produce su desorción, volviendo al estado gaseoso. Por último, se procede a su purificación y licuación para su venta.
Agradecimientos
Los autores agradecen a la empresa Carboneco la información técnica que les ha suministrado.
Bibliografía
Desideri, Umberto; Corbelli, Umberto. CO2 capture in small size cogeneration plants: technical and economical considerations, 39 (9): 857-867. (1998).
Freund, P. Making deep reductions in CO2 emissions from coal-fired power plant using cap. Proceedings of the Institution of Mechanical Engineers, 217 (1): 1-7, 2003.
Hao Hsu, Chia; Hsin Chu; Chorng Ming Cho. Absorption and reaction kinetics of amines and ammonia solutions with carbon. Journal of the Air & Waste Management Association, 53 (2): 246-252. (Feb 2003).
Kvaerner Asa, P.O. Un método para eliminar e impedir las emisiones a la atmósfera de dióxido de carbono (CO2) de gases de escape de motores térmicos. Ronning, Svein O.; Bjerve, Yngvil; Falk-Pedersen, Olav; Glittum, Geir; Bolland, Olav. Noruega, patente de invención NO2118574, 1995-02-14. (1995).
White, Curt M.; Strazisar, Brian R.; Granite, Evan J.; Hoffman, James S.; Pen, Henry W. Separation and capture of CO2 from large stationary sources and sequestration. Journal of the Air & Waste Management Association, 53 (6): 645-715. (Jun 2003).
Sociedad Española de Carburos Metálicos, S.A. Procedimiento para la obtención de CO2 y N2 a partir de los gases generados en un motor o turbina de combustión interna. Pascual Mercader, Juan; Rivera Vilamañan, Pablo. España, patente de invención ES 2003265, 1987-04-21. (1987).