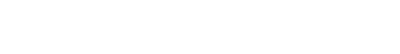Las pilas de combustible, un posible futuro energético

El objetivo es el desarrollo de prototipos de pilas de combustible como un sistema de generación de energía competitivo con los actuales, desde aspectos tales como eficiencia eléctrica, impacto ambiental, flexibilidad y modularidad.
Conceptos básicos
Las pilas de combustible son dispositivos que producen electricidad y agua mediante el proceso inverso a la electrólisis. Estos son dispositivos que teóricamente tienen la capacidad de producir energía eléctrica de forma indefinida mientras se suministra combustible y oxidante a los electrodos. Sólo la degradación o el mal funcionamiento de los componentes limitan la vida de operación práctica de las pilas de combustible.
El principio de funcionamiento en el que se basan las pilas de combustible es el inverso al de la reacción electrolítica; oxígeno e hidrógeno se combinan para formar agua con producción de energía eléctrica y calor. Se trata, por lo tanto, de una reacción limpia, en la que el único producto es el vapor de agua que puede ser liberado a la atmósfera sin ningún peligro para el medio ambiente.
Principio de funcionamiento de una celda de combustible
La unidad básica de una pila de combustible se denomina “monocelda”. Una celda está formada por un “sandwich” de dos electrodos porosos con una lámina de electrolito entre ambos.
El hidrógeno (H2) penetra por el electrodo negativo (ánodo) y se disocia, en presencia del catalizador, en iones positivos H+ y electrones. El oxígeno (O2) procedente del aire penetra por el electrodo opuesto (cátodo) y se disocia igualmente en presencia del catalizador en iones O2-. Los iones positivos del hidrógeno se escapan a través del electrolito en dirección al cátodo, dejando a los electrones libres en el ánodo (figura 1).
Si existe un camino eléctrico entre el ánodo y el cátodo los electrones lo recorrerán, produciendo corriente eléctrica. En el cátodo los iones hidrógeno, el oxígeno y los electrones se vuelven a combinar para formar moléculas de agua.
Además de esta energía eléctrica se produce un importante desprendimiento de energía térmica en forma de calor.
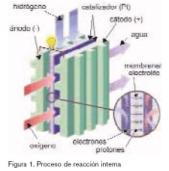
Una celda de combustible produce una diferencia de potencial algo mayor que un voltio en circuito abierto, por lo que, para producir tensiones más elevadas, se recurre a la disposición en serie de celdas formando un stack o apilamiento, (figura 2). A este apilamiento de celdas debidamente implementado en una estructura que permita disipar el calor, posibilite la circulación necesaria de los gases, y ofrezca los terminales positivo y negativo para la utilización de la energía eléctrica producida, se le denomina Pila de Combustible.
Clasificación de las pilas de combustible
La clasificación de los tipos de pilas de combustible (tabla 1) se puede hacer por el tipo de electrolito que utilizan. Según este criterio, tendremos pilas de combustible que operan a diferentes temperaturas, que necesitan mayor o menor pureza del hidrógeno suministrado.
No todas las pilas de combustible están en la misma fase de desarrollo; las pilas poliméricas y de ácido fosfórico se hallan en un estado más próximo a la comercialización que el resto de las alternativas tecnológicas.
“EL PRINCIPIO DE FUNCIONAMIENTO EN EL QUE SE BASAN LAS PILAS DE COMBUSTIBLE ES EL INVERSO AL DE LA REACCIÓN ELECTROLÍTICA; OXÍGENO E HIDRÓGENO SE COMBINAN PARA FORMAR AGUA CON PRODUCCIÓN DE ENERGÍA ELÉCTRICA Y CALOR”
Pilas de combustible de membrana polimérica (PEMFC)
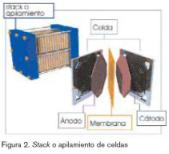
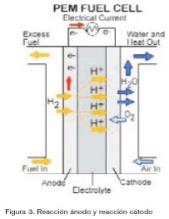
La pila de combustible de membrana de intercambio protónico o pila de combustible polimérica (PEM) (figura 3) ofrece densidades de corriente mucho mayores que las de cualquier otro tipo de pilas de combustible, con la excepción a algunas pilas alcalinas desarrolladas para aplicaciones espaciales. Las pilas PEM pueden ser alimentadas por combustibles reformados y con aire. La utilización de un polímero sólido como electrolito elimina la corrosión y los problemas de seguridad asociados a los electrolitos líquidos. Su temperatura de funcionamiento es baja, lo que permite arranques instantáneos y no requiere aislamientos térmicos. Se apunta hacia la reducción de costes.
Las pilas tipo PEM utilizan un polímero sólido como electrolito. Esta membrana es un aislante electrónico, pero un excelente conductor de iones hidrógeno. Los materiales utilizados para este tipo de membranas son polímeros fluorocarbonados parecidos al teflón, al cual se le añaden sulfonic acid groups. Las moléculas ácidas se fijan en el polímero y no pueden separarse, pero los protones de estos grupos ácidos pueden migrar a través de la membrana. Al ser la membrana sólida, no hay problemas de pérdida de electrolito que pueda afectar a la vida de la pila de combustible.
El ánodo y el cátodo se preparan aplicando una muy pequeña cantidad de platino en una de las caras de una superficie porosa de grafito, que ha sido antes impermeabilizada con teflón. El electrolito se sitúa entre los dos electrodos, y los tres componentes se sellan a presión para producir una MEA (Membrane Electrode Assembly). Este conjunto es el corazón de la pila de combustible y mide menos de un milímetro de ancho.
El ánodo y el cátodo se ponen en contacto por la parte de atrás por placas de grafito con canales. Los electrones circulan por el espacio entre canales lo que permiten la circulación de la corriente eléctrica por un circuito externo.
Las reacciones que tienen lugar en los electrodos en una pila tipo PEM son análogas a las de la PAFC. El hidrógeno de entrada se consume en el ánodo, separándose en electrones que circulan por el circuito externo y en protones hidrógeno que atraviesan y entran en la membrana. En el cátodo, el oxígeno se combina con los electrones y los iones hidrógeno para producir agua. El agua no se disuelve en el electrolito sino que se expulsa con el gas de alimentación del cátodo. Como las pilas tipo PEM operan a unos 60 ºC, el agua se produce de forma líquida y se expulsa por el excedente de flujo de alimentación del cátodo.
Se consiguen densidades de corriente cercanas a los 900 mA/cm2 a una tensión de 0.7 V por celda con hidrógeno y oxígeno a unas cuatro atmósferas de presión. Si el hidrógeno y el oxígeno se introducen a presión ambiente, se pueden alcanzar densidades de 530 mA/cm2.
Las densidades de corriente descritas anteriormente son diez veces mayores a las de otros sistemas de pilas de combustible. Esto hace pensar que el potencial de las PEM en cuanto a reducción de tamaño y coste es enorme. En un stack de 5 kW, Ballard ha alcanzado a 0.7 V densidades de corriente cercanas a 680 mA/cm2. Las dimensiones del stack son 250 x 250 x 425 mm, por lo que se obtienen rendimientos de 190,7 kW/m3, aunque se puede alcanzar seguramente en los próximos años cifras que se aproximen a los 500 kW/m3.
La eficiencia eléctrica de un stack depende mucho de la tensión a la cual cada monocelda opera. Para una misma tensión, una PEM es capaz de entregar mucha más corriente y por consiguiente más potencia que pilas como las PAFC, MCFC o SOFC, o lo que es lo mismo, para una misma potencia una pila tipo PEM tiene tamaño más reducido y menor coste.
Sin embargo, si utilizamos como combustible hidrocarburos, la eficiencia de las pilas como MCFC o SOFC es mayor, ya que el calor que producen se puede utilizar en el proceso de reformado de manera más eficiente, además de poder aprovechar este calor residual para producir más electricidad con cogeneración. En el caso de una PEM, el calor que se evacua en el circuito de refrigeración es de baja calidad y sólo se puede aprovechar para agua caliente o aplicaciones similares.
Cuando una PEM opera con hidrocarburos reformados, el CO producido en el proceso debe ser eliminado y convertido en CO2 por un proceso de oxidación.
Una PEM puede operar con aire. Como ocurre con el resto de las pilas de combustible, si se aumenta la presión de los flujos de entrada, las prestaciones mejoran. Para las distintas aplicaciones hay que barajar si merece la pena el gasto en presurizar los flujos de entrada con el aumento de la eficiencia. Sin embargo, presiones superiores a las cinco atmósferas empiezan a ser dañinas para los sistemas. Otra posibilidad, ya que la membrana es sólida y es capaz de soportar diferenciales de presión entre los dos flujos del ánodo y cátodo, es que se puede optimizar la pila para presiones diferentes de combustible y aire.
Otro de los gastos más significativos en las PEM son los catalizadores de platino, por lo que en los últimos años se ha tratado de reducir la cantidad de platino necesaria para la reacción. Se espera que se sigan reduciendo estas cantidades para poder reducir el coste de las pilas de combustible.
“LA PILA DE COMBUSTIBLE DE ÁCIDO FOSFÓRICO (PAFC) ES LA TECNOLOGÍA MÁS MADURA EN CUANTO A DESARROLLO Y COMERCIALIZACIÓN SE REFIERE”
Se han demostrado vidas útiles cercanas a las 50.000 horas pues operan a temperaturas bajas y el electrolito es sólido. Las PEM operan a temperaturas cercanas a los 70 ºC y aproximadamente el 50% de la potencia se puede obtener de forma inmediata a temperatura ambiente; la potencia máxima se puede conseguir después de tres minutos de operación.
Pilas de combustible alcalinas (AFC)
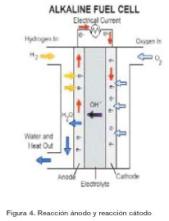
Las pilas de combustible alcalinas (AFC, del inglés Alkaline Fuel Cells) (figura 4) estaban orientadas a suministrar energía eléctrica y agua en las naves espaciales norteamericanas de los años 60. El electrolito utilizado es una solución de hidróxido de potasio diluido y utilizan una gran variedad de metales no precisos como catalizadores.
La temperatura de funcionamiento de las AFC ronda los 70-120 ºC, y suelen operar a presión atmosférica. La tensión de las celdas suele ser 0.8 V y la densidad de corriente está en torno a los 1500A/m2. El combustible debe ser hidrógeno puro y su eficiencia ronda el 55%. La vida útil ronda el año de operación. Los electrodos suelen ser de níquel y óxido de níquel, o de carbono dopado con platino.
Uno de los mayores problemas que surgen es que el combustible debe ser hidrógeno de gran pureza con nula concentración de CO o CO2. Si existen restos de CO2, éste es absorbido por el KOH y se forma carbonato potásico, lo que reduce enormemente la eficiencia de la pila de combustible. Otra opción es utilizar amoniaco como portador de hidrógeno.
Otro problema de este tipo de pilas de combustible es la circulación de la corriente, ya que se tienen intensidades muy altas con tensiones muy pequeñas. Las celdas se suelen conectar en serie para aumentar la tensión hasta 110 o 220 V. Los puntos críticos de conexión suelen ser de plata, lo cual aumenta mucho el coste.
La principal prestación que ofrecen las AFC es su funcionamiento a baja temperatura, la cual permite alcanzar eficiencias del 55 al 60%, mucho mayor que cualquier proceso térmico sometido al principio de Carnot. La baja temperatura permite que la duración de los componentes sea mayor.
Pilas de combustible de ácido fosfórico (PAFC)
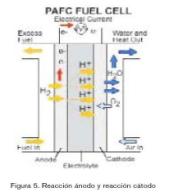
La pila de combustible de ácido fosfórico (PAFC) (figura 5) es la tecnología más madura en cuanto a desarrollo y comercialización se refiere. La pila de combustible de ácido fosfórico (PAFC) tuvo un crecimiento considerable hace unos años, ya que se creía que era la única tecnología que podía proporcionar una tolerancia relativa a combustibles provenientes de hidrocarburos reformados, por lo que su implantación sería mas fácil a corto plazo.
La pila de combustible de ácido fosfórico utiliza ácido fosfórico como electrolito. Éste está contenido en una matriz de carbide silicone bonded with teflon. La estructura porosa de esta matriz evita fugas de electrolito por efecto capilar. Sin embargo, algo de ácido sí puede perderse en los flujos de combustible y oxidante, por lo que tras unas horas de operación debe añadirse algo de ácido. Los catalizadores son de platino y los electrodos de carbono poroso.
El subproducto del proceso es agua, la cual se elimina con el oxidante en el cátodo (aire u oxígeno). El procedimiento de eliminación de este agua requiere que el sistema opere a temperaturas cercanas a los 190 ºC. A temperaturas menores, el agua se disolvería en el electrolito y no se podría eliminar. A temperaturas mayores, el ácido fosfórico se descompondría.
El exceso de calor se recoge con intercambiadores situados en las placas de carbón para cada celda. El refrigerante puede ser líquido o gaseoso, aunque normal-mente se utiliza agua.
En el ánodo, el hidrógeno se separa en dos protones (H+), los cuales atraviesan el electrolito hasta el cátodo. Los dos electrones pasan por un circuito externo hasta el cátodo. Como pasa en las PEM, en el cátodo se unen los electrones con los protones y los átomos de oxígeno para producir agua.
Las plantas de generación basadas en esta tecnología ofrecen eficiencias entre el 36 y el 42%. Eficiencias mayores se pueden alcanzar con flujos de combustible y oxidante presurizados, lo que por otra parte conlleva un mayor gasto en los elementos del sistema. La energía térmica que se puede obtener de este tipo de pilas de combustible ronda entre el 37 y el 41%. La densidad de potencia de este tipo de pilas de combustible está en torno a los 0,18 W/cm2.
Pilas de combustible de carbonatos fundidos (MCFC)
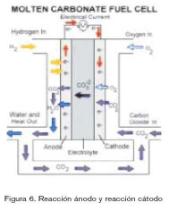
La pila de combustible de carbonatos fun-didos (MCFC, del inglés Molten Carbonate Fuel Cell) (figura 6) evolucionó desde los trabajos realizados a principios del año 1960, que trataban de encontrar una pila de combustible que trabajase directamente con carbón como combustible. Aunque a fecha de hoy se ha demostrado que el funcionamiento directo con carbón no es viable, sí se ha demostrado que puede estar alimentada con GLPs como el gas natural.
La pila de combustible de carbonatos fundidos utiliza una sal de carbonato fun-dido como electrolito. Normalmente se utiliza carbonato de litio o carbonato de potasio. Su temperatura de operación está en torno a los 650 ºC, a la cual esta sal es líquida y se comporta como un buen conductor iónico. Este electrolito está contenido en una matriz cerámica porosa e inerte, normalmente LiAlO2.
La reacción anódica ocurre entre el hidrógeno y los iones carbonato (CO3-) del electrolito, lo que da como productos CO2 y agua, además de liberar electrones. La reacción catódica combina el oxigeno, el CO2 y los electrones que han circulado por el circuito externo, produciendo otra vez iones carbonato que se unen al electrolito. Existe pues una necesidad de CO2 en el oxidante, por lo que hay que dotar a estas pilas con un sistema de captación de CO2 para su funcionamiento.
Según la temperatura va aumentando, la tensión teórica de operación de la pila de combustible disminuye, al igual que su eficiencia. Por otro lado, al aumentar la temperatura incrementa la velocidad de reacción electroquímica y, por lo tanto, la corriente entregada para una tensión fija. En comparación con otras tecnologías, una MCFC es capaz de operar a tensiones más altas que una PAFC para la misma densidad de corriente. Por todo ello, teóricamente una MCFC debería ser para la misma potencia más pequeña y más barata que una PAFC con las mismas características.
La pila de combustible de carbonatos fundidos produce también energía térmica en el proceso, pudiendo ésta ser aprovechada en una turbina de gas para cogenerar. En un ciclo combinado de ambas tecnologías, se ha estimado que la MCFC puede alcanzar eficiencias del 60%.
La temperatura de operación se fija entre 600 y 650 ºC, a la cual se alcanza la conductividad iónica suficiente del electrolito. Para mantener esta temperatura, se necesita un gran volumen de aire que circula para evacuar el calor del cátodo. Esta temperatura sirve también para poder operar directamente con gases carbonatados como el gas natural, ya que posibilitan el reformado interno.
La necesidad de CO2 en el flujo oxidante, requiere que el CO2 se recolecte en el ánodo y se mezcle con la entrada de aire. Antes de esto, cualquier hidrógeno residual no consumido del combustible de entrada debe ser quemado. En sistemas futuros se podrá intentar incorporar membranas selectivas para eliminar el hidrógeno del flujo de aire recirculado.
A la temperatura que opera una pila de combustible de carbonatos fundidos no se precisan catalizadores de metales nobles. El ánodo está compuesto por polvo de níquel sinterizado, dándole un carácter altamente poroso al que normal-mente se suele añadir algo de cromo para prevenir aglomeraciones. El cátodo está compuesto por óxido de níquel con algo de litio. Se ha trabajado mucho en desarrollar estructuras de los electrodos con una posición adecuada respecto al electrolito a altas temperaturas.
Algunos de los factores significativos en las MCFC son la corrosión del cátodo que reduce la vida útil de la pila considerablemente y la necesidad de mantener la temperatura constante, ya que una caída de 30 ºC reduce la tensión de salida en un 15% aproximadamente, dado el incremento de resistencia iónica y eléctrica de los electrodos.
Pilas de combustible de óxidos sólidos (SOFC)
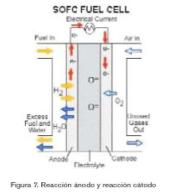
La pila de combustible de óxidos sólidos (SOFC, del inglés Solid Oxide Fuel Cell) (figura 7) utiliza un electrolito sólido cerámico que reduce la corrosión y elimina los problemas asociados a la gestión de los electrolitos líquidos. Sin embargo, para que una cerámica pueda alcanzar una conductividad iónica aceptable se necesitan temperaturas cercanas a los 1.000 ºC. A estas temperaturas, el reformado interno también es posible, además de poder utilizar el calor residual para cogeneración y aumentar así la eficiencia del sistema global.
La pila de combustible de óxidos sólidos utiliza un electrolito cerámico sólido. El material preferido hoy en día es la zirconia estabilizada con ytrio, un conductor excelente de iones de oxígeno cargados negativamente a altas temperaturas.
Las SOFC son dispositivos completamente sólidos que tienen técnicas de fabricación parecidas a las de los semiconductores. El ánodo es de zirconica/níquel poroso, mientras que el cátodo es un manganato de lantanio dopado con magnesio. El diseño de la pila de Westinghouse se construye en un soporte tubular de circonia en el cual el suministro de aire al cátodo se encuentra fuera del tubo. A continuación se deposita una capa de electrolito en la parte externa del cátodo y finalmente se sitúa el ánodo encima del electrolito. Se conectan un gran número de celdas con contactos semiconductores de alta temperatura.
En operación, el hidrógeno o el monóxido de carbono (CO) del combustible reacciona con los iones oxígeno (O=) del electrolito para producir agua o CO2 y depositar electrones en el ánodo. Los electrones pasan por un circuito externo y vuelven al cátodo, donde reaccionan con el oxígeno del aire y forman de nuevo los iones (O=) que se incorporan al electrolito. Es importante destacar que las SOFC pueden utilizar CO o hidrógeno como combustible.
En el desarrollo de pequeños stacks, la SOFC ha demostrado alcanzar tensiones de 0.6 V/celda y densidades cercanas a los 0.25A/cm2. Su vida útil está cercana a las
30.000 horas y pueden soportar un número bastante considerable de ciclos de calentamiento/enfriamiento. Hoy en día, las SOFC con gases a presión ambiente han demostrado eficiencias cercanas al 45%, aunque hay laboratorios que publican eficiencias cercanas al 60% con los gases de entrada presurizados. Si además el calor se aprovecha para cogeneración, esta eficiencia sube considerablemente, ya que el calor residual es de alta calidad.
Como se ha mencionado anteriormente, las SOFC permiten el reformado interno, y como ocurre con las MCFC, el CO no actúa como veneno, sino que puede utilizarse como combustible. Estas pilas también tienen la ventaja de ser resistentes al azufre contenido en la mayoría de los combustibles.
Debido a la alta temperatura de operación de este tipo de pilas de combustible, el tiempo de arranque es bastante grande, y las prestaciones de las celdas son muy sensibles a variaciones de esta temperatura. Un caída del 10% en la temperatura puede suponer una caída del 12% de la eficiencia del sistema debido al aumento de la resistencia interna en la conductividad de los iones oxígeno. Las altas temperaturas que se alcanzan también obligan a la utilización de aislantes térmicos sofisticados para proteger al personal y mantener el calor.
Por todas esta características, este tipo de pilas de combustible son ideales para aplicaciones estacionarias, pero no para el sector del transporte o dispositivos portátiles.
Bibliografía
Asociación Española de Pilas de Combustible.
Mundo Científico nº 233, Abril 2002, p. 66.
I Ciclo conferencias divulgación CSIC – Fundación BBVA.