Entropía, la fuerza impulsora de los procesos naturales
Esta intrigante magnitud, que significa evolución o transformación, es una medida del desorden que crece en los procesos que se dan de forma natural.
Vamos a tratar de explicar de forma sencilla lo que es la entropía, función termodinámica de enorme importancia en la industria química sobre todo, pero que es una gran desconocida para todos los que no nos dedicamos a investigaciones de temas energéticos. Ella es la fuerza que impulsa los procesos naturales con los que convivimos a diario, y entre ellos las reacciones químicas espontáneas, que serán el objeto central del artículo. Utilicé datos de una Bibliografía que creo que es muy asequible a todos, definiendo los conceptos con sencillez y claridad.

Conceptos
No es fácil encontrar unas definiciones asequibles, adecuadas a la vida ordinaria, que es donde la mayoría de nosotros podemos aplicar el concepto de entropía, y entender por qué se producen muchos procesos en nuestro entorno de forma natural y espontánea. Muchos libros la definen de una manera un poco complicada, aunque rigurosamente exacta por supuesto, pero de difícil comprensión para los que no estamos a esos niveles de especialización.
Primero procederemos a definir algunos conceptos que podemos tener un poco olvidados.
Un proceso se dice que es espontáneo cuando tiene “fuerza” impulsora suficiente para transcurrir por sí mismo. Si no tiene esa “fuerza” impulsora propia, y tenemos que suministrársela nosotros a través de una energía, entonces decimos que es no espontáneo. Son procesos espontáneos: La bajada del agua de los ríos desde las montañas hasta el mar. La disolución de un terrón de azúcar en el café. La disolución del ClK en agua. La descomposición, a veces explosiva, del N2O5 según la siguiente reacción química N2O5(sólido) => 2NO2(gas) + 1/2 O2(gas), con gran absorción de calor. La oxidación del hierro expuesto al medio ambiente. La fusión del hielo a temperatura ambiente superior a 0 ºC. El paso del calor de un cuerpo caliente a uno más frío. La rotura de un vaso de cristal cuando se cae al suelo. Todos estos procesos se producen por sí solos, sin intervención nuestra.
Son procesos no espontáneos los opuestos a los anteriores: El agua no sube del mar a las montañas. El azúcar y el ClK disueltos no vuelven a agruparse en cristales mientras estén en su disolvente. El hierro oxidado no se vuelve brillante. El calor no pasa de un cuerpo frío a uno con más temperatura. El vaso roto no vuelve a reconstruirse. Para realizar estos procesos no espontáneos tenemos que aplicar una energía por nuestra parte, pues por sí solos no se producen.
Vemos que los procesos que ocurren espontáneamente en una dirección no ocurren espontáneamente en la opuesta.
El que un proceso sea espontáneo no quiere decir que se produzca de forma rápida o inmediata, puede llevarle mucho tiempo efectuarse. Ejemplos: el H2 y O2 pueden permanecer juntos indefinidamente sin reaccionar, a pesar de ser una reacción espontánea. Sólo tiene que producirse una ligera chispa para iniciar la reacción, y entonces se produce de forma instantánea y violenta. El hielo a 0,2 ºC se funde, pero de forma muy lenta, etc. La termodinámica nos dice la tendencia de un proceso o de una reacción química a producirse de forma espontánea, pero no nos dice nada sobre la velocidad de dicho proceso o reacción química. La velocidad de dichos procesos la estudia la Cinética Química
Si una reacción química, o proceso químico, deseable es espontáneo, aunque lento, podemos encontrar medios para acelerar su velocidad, como un catalizador, una chispa, etc.. La reacción entre la gasolina y el aire en el interior de los cilindros de nuestro vehículo es muy lenta, pero la aceleramos empleando la chispa producida por las bujías en el momento oportuno.
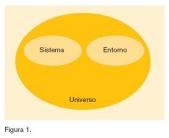
Por sistema entendemos el vaso, la sal, el azúcar, una reacción química, etc., y por entorno el ambiente que rodea directamente al sistema, como el aire, el recipiente donde realizamos la reacción química, el calorímetro, etc., o sea, lo que rodea al sistema. Ambos, sistema y entorno, forman el universo del proceso
o de la reacción química (figura 1).
Veamos ahora lo que se entiende por orden en termodinámica, aunque también vale para la vida diaria como podéis comprobar.
Cualquier situación que es tan concreta que solo se puede conseguir en una, o en un número pequeño de formas distintas pero equivalentes, decimos que está ordenada.
Cualquier situación que puede ser reproducida en muchos miles o millones de formas distintas, pero equivalentes, decimos que está desordenada.
La noción de orden y desorden se relaciona con la probabilidad de dicho suceso. Tomemos una baraja española de 40 cartas; si la colocamos por su orden natural (1,2,3,…7,10,11,12, oros, copas, espadas y bastos), sólo tenemos una situación conforme con ese orden. Vamos a calcular ahora el número de grupos o arreglos distintos en que se pueden encontrar esas 40 cartas si las barajamos, y son las permutaciones de 40 elementos P40= 40 × 39 × …. × 3 × 2 = 8,2 × 1047 (valor astronómico). Sólo hay una situación ordenada, en el orden que dijimos, y 8,2 × 1047 de desorden. Por eso decimos que es prácticamente imposible, si la barajamos, que la encontremos ordenada, e infinitamente probable que la encontremos desordenada. Pensemos en el número de arreglos posibles en que podemos encontrar un mol de un gas cualquiera, que tiene aproximadamente 6,02 × 1023 moléculas.
Un evento probable es aquel que puede ocurrir en muchísimas formas, y un evento improbable es aquel que sólo puede ocurrir en una, o en unas pocas formas.
Azar, desorden y entropía
Llegados aquí, vamos a ver qué es lo que tienen en común estos procesos espontáneos. A mediados del siglo XIX, científicos tan destacados y cualificados como Berthelot y Thomsen, pensaron, equivocadamente, que eran espontáneos los procesos exotérmicos (“los procesos naturales ruedan cuesta abajo en cuestiones de energía”). Esto no es así porque hay procesos que absorben calor (endotérmicos), y se producen de forma espontánea, como la disolución de sales, la fusión del hielo a temperatura ambiente superior a 0 ºC, la descomposición del N2O5 con gran absorción de calor, etc.
Otros muchos científicos vieron, acertadamente, que lo que tenían en común los procesos o reacciones químicas espontáneas era el aumento del desorden que se producía, en ellas mismas o en su entorno, cuando reaccionaban: una sal o el azúcar cristalinos, tienen sus moléculas fijas en el cristal, sin poderse mover, solamente vibrar, pero al disolverse en un líquido, sus moléculas o iones están en cierto modo libres para moverse por la disolución, por lo que están mucho más desordenadas que cuando estaban fijas en el cristal correspondiente. El hielo es agua en forma cristalina, no pudiendo desplazarse sus moléculas, pero al fundirse y convertirse en agua líquida, las moléculas se pueden mover entre ellas, estando también más desordenadas que cuando formaban parte del cristal de hielo. El vaso al caer al suelo se rompe, y sus pedazos están más desordenados que cuando formaban parte del vaso, y aunque no se rompiera, al chocar contra el suelo su energía cinética se transformaría en calor, calentando el aire del entorno y el mismo vaso, con lo cual las moléculas de aire, al aumentar su energía interna se moverían más rápidamente, más desordenadamente de lo que estaban antes del golpe, y las moléculas del vaso vibrarían con más intensidad que antes del golpe, o sea, más desordenadamente.
Como vemos, la espontaneidad está asociada con un incremento en lo aleatorio o desordenado del sistema o sus alrededores, o de ambos a la vez. Existe una tendencia de la naturaleza a evolucionar hacia un estado de mayor desorden molecular, y macromolecular también (nosotros solemos ser desordenados por naturaleza).
Aquí es donde nos vamos a encontrar con la entropía.
Se comprobó experimentalmente que la espontaneidad no estaba relacionada con la energía cedida al medio ambiente, sino con la energía cedida al medio ambiente dividida por la temperatura absoluta de dicho medio ambiente, y así se definió en la década de 1860.
S = Q / T = -?H / T
Y se le dio el nombre de entropía, y el símbolo, S, (Clausius). Y Boltzmann, en 1877, demostró que este desorden se puede medir matemáticamente, y lo hizo, definiéndola como
S = K LnW
Donde K es la constante de Boltzmann, y W es el número de posibles arreglos de los átomos o moléculas o iones que intervienen en la reacción química (en el ejemplo de la baraja sería el número 8,2 × 1047).
La entropía es, pues, una medida del desorden o del azar que hay en un sistema o en su entorno.
Segundo principio de la termodinámica
Todo esto está relacionado con el segundo principio de la termodinámica, que es una ley natural y se define de muchas formas, pero todas relacionadas con estos conceptos. Vamos a dar algunas de dichas definiciones tomadas de los textos de la Bibliografía:
En todo proceso espontáneo siempre hay un incremento en el desorden, y por tanto, en la S del universo.
La entropía del universo aumenta continuamente.
No se puede transferir calor desde un objeto frío a un objeto caliente sin consumir trabajo para realizar la transferencia.
No es posible la transformación de un 100% del calor en trabajo, cualquiera que sea el motor que se emplee.
El trabajo puede disiparse íntegramente en forma de calor, mientras que el calor no puede convertirse íntegramente en trabajo.
No se puede convertir una cantidad de calor completamente en trabajo sin que pase parte de este calor a una temperatura más baja.
Ningún proceso que produzca orden (disminución de la S) en un sistema puede efectuarse sin producir un desorden aún mayor (aumento de la S) en sus alrededores.
Los procesos naturales tienden a moverse hacia un estado de mayor desorden.
Reacciones espontáneas
Un sistema químico busca no solamente el estado de mínima energía o entalpía (proceso exotérmico como decían Bertholet y Thomsen), sino también el estado de máximo desorden. Y como hemos visto, el desorden, la entropía, es lo fundamental.
Como el universo está formado por el sistema y su entorno, si la S del sistema disminuye en un proceso espontáneo, la S del entorno debe aumentar lo suficiente para que el cambio total en S sea positivo, como requiere el segundo principio:
?S del universo = ?S del sistema + ?S del entorno > 0 para un proceso espontáneo.
Lo fundamental es que la S del universo debe aumentar, ser > 0
Para saber si una reacción química es termodinámicamente posible, o espontánea, sólo hay que calcular las entropías de la reacción en sí, y de su entorno, sumarlas algebraicamente, y si la suma es positiva, la reacción es espontánea, como dice el segundo principio. Si la suma es negativa, la reacción no es espontánea, y para que se efectúe tenemos que aplicarle una energía. También quiere decir que será espontánea la reacción inversa. Ejemplos:
2 H2O => 2 H2 + O2
Esta reacción tiene un ?S del universo negativo, por lo que no será espontánea, y para que se realice tenemos que aplicarle energía, en este caso a través de la electrólisis. Esto quiere decir que la reacción inversa será espontánea:
2 H2 + O2 => 2 H2O
Esta reacción tiene un ?S del universo positivo, por tanto será espontánea.
Para calcular las S de los elementos y compuestos existen tablas con estos valores, y de otras funciones termodinámicas.
El ?S de una reacción es igual a la suma de los ?S de los productos de la reacción, menos la suma de los ?S de los reactivos.
?S(reacción) = S?S(productos) – S?S(reactivos)
El ?S del entorno se calcula dividiendo la entalpía (?H) de la reacción, cambiada de signo, entre la temperatura absoluta del medio. Como referencia las tablas dan todas las funciones termodinámicas a la temperatura de 25 ºC, o sea de 298 ºK.
Hay una reacción que todos conocemos y que la podemos considerar típica de las situaciones consideradas anteriormente, como un resumen:
4 Fe(sól.) + 3 O2 (gas) => 2 Fe2O3 (sól.) ?H=-1644 KJ
En esta reacción, que es espontánea como todos sabemos (el hierro se oxida en el ambiente), partimos de un sólido, el Fe, cristalino, cuyos átomos no se pueden mover, sólo vibrar, por lo que su S es baja, y de un gas, O2, que por ser gas tiene muchas posibilidades de movimiento, por lo que su S, o desorden, es alto, y al reaccionar obtenemos un sólido, Fe2O3, que por no tener movimiento sus moléculas, sólo vibran, tendrá una S también pequeña. A simple vista, ya vemos que están más desordenados los reactivos (un sólido y un gas) que los productos (un sólido), por tanto el ?S de esta reacción, el sistema, será negativo, como se puede comprobar realizando los cálcu los correspondientes, y a pesar de ello es una reacción espontánea. Esto parece estar en contradicción con el segundo principio, que dice que en los procesos espontáneos tiene que aumentar la S, no disminuir. Pero si nos fijamos bien, el segundo principio dice que lo que tiene que aumentar es la S del universo, y que si la S del sistema (reacción química) disminuye, la S del entorno (ambiente) tiene que aumentar lo suficiente para contrarrestar la disminución de la S del sistema, y que el cambio total sea positivo. Esto es lo que ocurre en esta reacción, que al ser muy exotérmica, (?H=-1644 KJ), calienta las moléculas del aire del entorno mientras reacciona, aumentando su energía interna, y con ello su movilidad, y su desorden o S. Si se calcula el ?S de esta reacción (sistema), obtenemos un valor de ?S = -543 J/ºK.
Y calculando el ?S de su entorno obtenemos un valor de
?S = -?H/(25+273) º? = +1644KJ/298 ºK = +5510 J/ºK S
Si sumamos estos valores obtenemos la variación del ?S del universo, que en este caso es de
?S = +5510 J/ºK –543 J/ºk = +4974 J/ºK,
valor alto, lo que quiere decir que es una reacción espontánea, como se comprueba a diario y de acuerdo con el segundo principio: el hierro se oxida espontáneamente en el ambiente. (En realidad se produce una mezcla indefinida de varios óxidos hidratados distintos, pero es más complicado su cálculo, y como ejemplo vale el cálculo del óxido normal)
La mayoría de las reacciones exotérmicas son espontáneas, de aquí seguramente partió la equivocación de Berthelot y Thomsen. Las reacciones que empleamos para obtener calor y trabajo tienen que ser exotérmicas, pues si no desprenden calor no podemos obtener trabajo de ellas, ni calentarnos cuando hace frío.
La explicación de la espontaneidad está en el aumento del desorden del universo, o ?S, que aumenta, y no en la exotermicidad, aunque ésta favorece la espontaneidad, pero no la garantiza.
Recordemos que hay reacciones y procesos endotérmicos y que son espontáneos.
Un estado ordenado tiene una probabilidad baja de ocurrir y una S pequeña, un estado desordenado tiene una probabilidad alta de ocurrir, y una S alta. Es mucho más fácil el desorden que el orden, incluso en nuestra vida, pues tendemos más al desorden que al orden. Tanto las S de los elementos como de los compuestos son positivas.
En general, las S de los sólidos son menores que las de los líquidos, y las de los líquidos mucho menores que las de los gases.
S(sólidos) < S(líquidos) << S(gases).
Tercer principio de la termodinámica
En el cero absoluto de temperaturas (-273 ºC) cualquier sustancia está formando un cristal sin ningún tipo de movimiento, ni siquiera vibraciones, por lo que W=1 (un solo estado o arreglo posible), por muchas moléculas que tenga. Si aplicamos la fórmula de Boltzmann, tenemos S=K Ln 1=K 0=0, lo que supone que en el cero absoluto de temperaturas la S es cero, para cualquier sustancia (tercer principio de la termodinámica).
A partir del cero absoluto de temperaturas, según va subiendo la temperatura, los átomos y moléculas de cualquier sustancia van aumentando su energía interna y empiezan a vibrar, cada vez más, y por tanto su S y desorden va aumentando también, llegando a licuarse unos, otros se vaporizan y otros permanecen sólidos al alcanzar la temperatura ambiente. A partir del tercer principio se calculan las tablas con los valores de las entropías.
En general
Los humanos realizamos grandes obras de ingeniería que son estructuras altamente ordenadas, y esto parece contradecir también el segundo principio, pero para obtener el acero, el cemento, los plásticos, etc. que necesitamos para nuestras construcciones, tenemos que gastar grandes cantidades de energía, deteriorando el medio ambiente al calentarlo, lo que hace que la S del entorno aumente, y este aumento de la S del entorno es mucho mayor que la disminución de la S por el orden creado en las obras, con lo cual la S del universo aumenta considerablemente. Toda nuestra vida es un aumento constante de la S del universo, tanto en lo que se refiere a nuestro cuerpo mismo como en nuestros alrededores. El ser vivo, para vivir, toma del entorno energía de alta calidad, como los alimentos, que son moléculas grandes que pueden llegar a tener varios millones de átomos, muy ordenadas, por tanto de baja S, y devuelve energía de baja calidad, como el calor corporal, los excrementos, el sudor, y demás desechos orgánicos, que suelen ser moléculas más simples, con menos átomos, muchas son gases, y mucho más numerosas, y por tanto, con mucha mayor S en conjunto. Y al morirnos nos descomponemos en multitud de moléculas pequeñas, muchas de ellas gaseosas, aumentando mucho la S del universo. Así es la vida, un continuo aumento de la entropía.
Nuestro cuerpo contiene billones de células, cada célula contiene millones de moléculas, que a su vez contienen miles de átomos. Nuestro cuerpo es, pues, una estructura altamente organizada, lo que supone que tengamos una S muy baja, esto a su vez implica que en términos termodinámicos seamos muy poco probables, pero existimos.
La energía del universo se conserva (primer principio de la Termodinámica) La Entropía del universo aumenta continuamente (segundo principio de la termodinámica).
En el cero absoluto de temperatura la Entropía de un cristal perfecto es cero (tercer principio de la termodinámica).
Bibliografía
Chang, Química . McGraw-Hill Interamericana. México.
1992. Brown, LeMay y Bursten. Química, la ciencia central. Prentice-Hall Hispanoamericana. México. 1993. Barrow. Química general. Reverté. Barcelona. 1974 Pimentel y Spatley. Química razonada. Reverté. 1978. Dickerson, Gray y Haight. Principios de química. Reverté.
1985 Giancoli. Física, principios y aplicaciones. Reverté. 1985