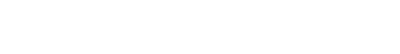Desinfección del agua con cloro y cloraminas
Las reglamentaciones cada vez más restrictivas para conseguir un agua de calidad sanitaria óptima exigen considerar distintas técnicas desinfectantes

Introducción
Muchas de las grandes epidemias que ha azotado a la humanidad han venido generalmente por la vía de la contaminación del agua. Aunque en la actualidad han sido prácticamente dominados estos problemas, no quiere decir que hayan desaparecido los peligros que pueden originar las diferentes contaminaciones del agua. Este es el principal motivo que impulsa a aplicar continuamente los procesos técnicos más actuales y el empleo de nuevos productos: conseguir, mediante el tratamiento adecuado, un agua de calidad sanitaria óptima, teniendo en cuenta que el agua, en sus diferentes fuentes de captación, está cada vez más deteriorada.
La desinfección del agua, y más concretamente la cloración, está siendo objeto de polémica en los últimos años como consecuencia, principalmente, de los subproductos de la desinfección, llegando a cuestionarse la necesidad de la propia desinfección en muchos casos.
La reciente transposición de la Directiva Europea relativa a la calidad de las aguas destinadas al consumo humano exige que el agua sea desinfectada, y fija unos valores o parámetros indicadores de cloro libre y residual en la red de abastecimiento si se utiliza cloro o sus derivados en el tratamiento del agua (1 mg/l para cloro libre y 2 mg/l para cloro combinado). La Directiva Europea fija unas características microbiológicas mínimas que los distintos países miembros deberán mantener, siendo por tanto éstos los que decidirán el empleo o no del desinfectante apropiado para cumplir con los valores paramétricos exigibles.
Muchos países, dentro y fuera de la UE, debido a las características de sus aguas, generalmente superficiales, acuden a la desinfección principalmente con cloro y mantienen una determinada concentración de residual en sus redes de distribución. Esta desinfección puede conllevar la generación de sustancias perjudiciales para la salud de los consumidores, conocidas como subproductos de la desinfección, con valores máximos fijados en las diferentes reglamentaciones y que han sido a veces el motivo de que no se empleen determinados desinfectantes o al menos de que se replantee su empleo. En cualquier caso, como la misma Organización Mundial de la Salud indica, no se debe comprometer o dejar en segundo término una correcta desinfección ante los efectos a largo plazo que originarían los subproductos de la desinfección.
Comoquiera que en las redes de los sistemas de distribución es necesario, y a veces obligatorio en algunos países, el mantenimiento de un desinfectante residual, que precisamente en numerosas circunstancias incrementa la formación de subproductos, se está acudiendo en muchos abastecimientos al empleo de las cloraminas como desinfectante secundario (posdesinfección), para mantener durante más tiempo una determinada concentración de cloro residual combinado en la red y generar menos subproductos de la desinfección, especial-mente trihalometanos.
El cloro presente en el agua tratada, que se conoce como “cloro residual”, puede presentarse como “cloro residual libre” o como “cloro residual combinado”. El cloro residual libre está constituido esencialmente por el ácido hipocloroso y el ión hipoclorito; y el cloro residual combinado lo forman generalmente las cloraminas. Para que el cloro residual libre esté presente en un agua tratada con cloro después del suficiente tiempo de contacto, es necesario que la cloración se lleve a cabo mediante una dosis lo suficientemente elevada de cloro, hecho conocido como “dosificación con cloro sobrante”, “cloración por el punto crítico” o “cloración al breakpoint”, con lo cual el cloro oxidará todas las sustancias que estén en disposición de ser oxidadas, se combinará, destruirá y eliminará otras, como por ejemplo las cloraminas, y después de todo esto aún quedará un exceso de cloro libre residual. La dosis de cloro necesaria para que comience a aparecer el cloro libre residual es la llamada dosis de breakpoint.
En la figura 1 queda mostrado de forma gráfica lo anteriormente expuesto. El breakpoint es la dosis correspondiente al mínimo de la curva. Este punto no lo presentan claramente las aguas con poca materia orgánica o compuestos nitrogenados.
Cloro residual en la red de distribución
El consumo de cloro por el agua de una red de distribución se debe, por una parte, al consumo de este por sustancias presentes en el agua y por condiciones físico-hidráulicas tales como temperatura, agitación, turbulencias, etc.; y por otra, al consumo que se produce en la interfase con las paredes de las conducciones.
En el agua, el consumo depende principalmente de la temperatura y del contenido en materias orgánicas disueltas y otras inorgánicas capaces de ser oxidadas.
En la interfase con las paredes, el consumo de cloro se produce por la interacción con los productos de corrosión y por los depósitos y biomasa fijada en las paredes.
La disminución del cloro residual en una masa de agua viene expresada por la ecuación exponencial:
C(t) = C0.e-kt
C(t) = Concentración de cloro (mg/l) en el tiempo t.
C0 = Concentración inicial de cloro (mg/l) t = Tiempo de reacción.
Es decir, hay una disminución exponencial de cloro residual con el tiempo.
A título de ejemplo comparativo se muestran valores de C.t. para diversos desinfectantes:
Cloro = 15 (0.25 mg/l durante 60 minutos, o bien 0,5 mg/l durante 30 minutos)
Ozono = 1,6 (0,40 mg/l durante 4 minutos)
ClO2 = 10 (0,30 mg/l.durante 33 minutos)
Monocloramina = 100 (0,80 mg/l durante 120 minutos)
Las dos técnicas de cloración generalmente empleadas son la cloración residual libre y la cloración residual combinada (más la primera que la segunda).
La técnica de la cloración residual libre supone la aplicación de cloro al agua para conseguir que ya sea directamente, o bien después de la destrucción del amoníaco, quede cloro residual libre, tanto a la salida de la planta como en la red de abastecimiento.
La técnica de la cloración residual combinada implica la reacción del cloro con el amoníaco añadido (sin llegar a la destrucción de éste) y el mantenimiento de este cloro residual combinado en la red.
Empleando cloro como oxidante/ desinfectante primario, la formación de THMs y otros subproductos se ve favorecido con el aumento de la dosis de cloro y del tiempo de contacto agua-cloro, además de por otro factor primordial como es el contenido en precursores del agua objeto de desinfección. El producto de la concentración de cloro residual, en mg/l, y el tiempo de contacto, en minutos, es decir C.t., es un indicador del potencial de desinfección en el proceso de cloración.
Se presenta entonces el dilema de si mantener o no una determinada concentración de cloro residual para prevenir posibles recontaminaciones, recrecimiento del biofilm y otros objetivos que posteriormente se indicarán.
Si se mantiene un desinfectante residual en la red, como el cloro libre, habría que volver en algunos abastecimientos a reclorar el agua y mantenerla así durante el largo período de estancia que tiene lugar en muchos abastecimientos, es decir, aumentando los facto-res (C y t) que, precisamente, potencian la formación de THMs. La dificultad del cloro para mantener una concentración residual constante y estable a lo largo del tiempo, en muchos sistemas de distribución, le limita como un adecuado desinfectante secundario.
¿Sería conveniente entonces buscar una alternativa al cloro libre que además de no formar estos subproductos sea más estable y, por tanto, su concentración se mantenga casi constante desde que el agua sale de la estación de tratamiento hasta que llega al consumidor más alejado?. Aparece entonces, como una posible alternativa, la solución del cloro residual combinado, en forma de cloraminas.
Pueden aducirse varias razones a favor del mantenimiento de un desinfectante residual en el sistema de distribución:
1. Controlar y minimizar el recrecimiento del biofilm.
2. Reducir el riesgo de una contaminación por intrusión desde el exterior al interior del sistema de distribución
3. El uso de cloro residual y su control continuo servirá como indicador de roturas de un sistema de distribución, y puede ser usado para detectar intrusiones más rápidamente que una monitorización microbiológica y, además, su análisis continuo abarca o afecta a prácticamente todo el volumen de agua del sistema.
4. Estabilizar la calidad del agua en el sistema, no sólo en cuanto al control de la formación de biofilm y recrecimiento bacterianos, sino también a la reducción los fenómenos de corrosión de la red. La corrosión es un factor importante en la reducción del cloro residual.
Elección del desinfectante residual
Al igual que en la evaluación y selección del desinfectante primario o principal, se puede seguir un proceso en el que se valora, entre otros parámetros, la inactivación microbiológica, a la vez que se fija una concentración límite en la generación de subproductos. Para la selección de un desinfectante secundario se puede seguir un proceso equivalente.
Desinfectante secundario es el que se emplea en algunos sistemas de tratamiento y abastecimiento con el objetivo principal de mantener un desinfectante residual a lo largo del sistema de distribución. El empleo de uno u otro desinfectante secundario depende del desinfectante primario utilizado.
En la selección del desinfectante secundario es conveniente considerar tres factores que pueden estar real o potencialmente presentes en el agua que sale de la planta:
Concentración de carbono orgánico asimilable (COA): Generalmente se produce cuando el contenido de carbono orgánico total del agua es elevado y ésta ha sido tratada con un fuerte oxidante empleado como desinfectante principal, como puede ser el caso del ozono. En estos casos es aconsejable la filtración biológica o con carbono activo en grano del agua antes de salir de la planta de tratamiento.
Formación potencial de subproductos de la desinfección: Son los subproductos que se pueden formar en la red de distribución, principalmente si se emplea cloro.
Tiempo de retención en el sistema de distribución: En los sistemas de distribución extensos, o con tiempos de retención prolongados, pueden ser necesarias estaciones suplementarias de desinfección (recloración) para mantener una concentración deseada del desinfectante residual a menos que se utilicen desinfectantes suficientemente estables como las cloraminas.
Si se implanta el mantenimiento de un desinfectante residual, se debe minimizar este residual y los subproductos formados, para lo cual es necesario y fundamental:
- Tratar el agua para reducir la materia orgánica natural (MON) que sirve como precursor de los subproductos de la desinfección.
- Tratar el agua para mejorar la estabilidad del desinfectante residual, ya que cuanto más estabilidad del residual, menor desinfectante será necesario.
- Hacer una cuidadosa elección del oxidante/desinfectante siguiendo los criterios de máxima estabilidad, máximo control del biofilm, mínima toxicidad directa y mínima formación de subproductos.
En la tabla 1 se comparan las tres principales alternativas para el mantenimiento de un residual desde las perspectivas o criterios antes señalados:
- Estabilidad del residual.
- Toxicidad del residual.
- Control del biofilm.
- Formación de subproductos.
De las tres substancias indicadas, el cloro libre es el más utilizado pero su mal comportamiento en cuanto a la formación de subproductos limitará su empleo en el futuro a aguas con muy pocos precursores.
Las cloraminas, y concretamente la monocloramina, es una importante alternativa, siendo su principal desventaja el hecho de que está sujeta a una nitrificación en el sistema de distribución, por diferentes factores tales como alta temperatura, puntos muertos o retenciones excesivas donde el residual desaparece y el biofilm se elimina con dificultad, y exceso de amoníaco. Hay que tener presente que las cloraminas no suelen emplearse en la desinfección primaria. Son más empleadas en Estados Unidos que en Europa.
Se suelen emplear las cloraminas como desinfección secundaria después de aplicar la técnica de la cloración libre dentro del proceso de tratamiento hasta la etapa de filtración. A continuación, tras la filtración, se aplica amoníaco y más cloro, si es necesario, para lograr la concentración de cloro combinado (cloramina) deseado. Es decir, que después de destruir las cloraminas que pudieran haberse formado con el amoníaco o substancias orgánicas nitrogenadas presentes en el agua bruta y satisfacer la demanda de cloro de este agua, tras el breakpoint, quede aún cloro libre residual (cloración con cloro sobrante) que será transformado en cloro combinado al incorporar expresamente amoníaco.
Esta desinfección secundaria suele ser la fase final en los procesos de tratamiento que la realizan. En la figura 2 se muestra el punto de incorporación de las cloraminas en el proceso de tratamiento.
Cloraminas
Las cloraminas fueron identificadas como desinfectante en las primeras décadas del siglo XX al comprobarse que la desinfección con cloro tenía lugar en dos fases. En la fase inicial, el cloro al oxidar una serie de sustancias presentes en el agua, desaparece rápidamente y en una segunda fase, cuando en el agua hay presente amoníaco, la acción bactericida continúa, a pesar de que el cloro libre hubiera desaparecido, debido precisamente a la acción de las cloraminas formadas.
La combinación del amoníaco con el cloro en el proceso de tratamiento del agua, conocida también como cloración con cloro combinado o cloraminación, tuvo como primer objetivo aportar un desinfectante residual al agua más persistente que el cloro libre, a la vez que evitar ciertos sabores de algunos compuestos clorados. Más recientemente se extendió su empleo debido a una función importante de las cloraminas, que es la de no formar, o al menos formar en menor grado, los conocidos subproductos de la desinfección, especialmente los trihalometanos. Al ser más estables que el cloro libre, resultan muy efectivas para controlar el recrecimiento bacteriano en la red y las corrosiones de la misma.
La preocupación en las dos ultimas décadas por los subproductos de la cloración, principalmente los trihalometanos y ácidos haloacéticos, en el agua tratada en los sistemas de distribución, ha hecho aumentar el interés por las cloraminas como desinfectante alternativo, al formar menos subproductos de desinfección.
Cuando el agua objeto de la cloración contiene amoníaco u otros compuestos amoniacales, se forman compuestos de adición llamados cloraminas. A continuación vamos a tratar de estos compuestos, ya que en muchos casos se incorpora en la práctica de la desinfección final, amoníaco, para provocar expresamente la formación de cloraminas.
Las reacciones de formación de las cloraminas son:
NH3 + ClOH = ClNH2 + H2O
(monocloramina)
ClNH2 + ClOH = Cl2NH + H2O
(dicloramina)
Cl2NH + ClOH = Cl3N + H2O
(tricloramina)
La formación de una u otra cloramina, así como la velocidad de reacción, se ve regida por el pH del agua, la temperatura y la relación de cloro/amoníaco.
La distribución de la monocloramina y dicloramina se ajusta a la siguiente ecuación de equilibrio:
2 ClNH2 + H+ = Cl2HN + NH4+
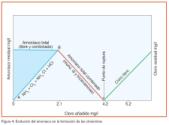
En el gráfico de la figura 3 (según Palín) se muestra la relación entre las diferentes especies de cloraminas en función del pH. A pH superior a 7 y una relación molar de cloro/amoníaco igual a 1 o menor, predominará la formación de monocloramina; su tasa de formación es muy rápida (su rapidez será máxima a pH = 8,3). La tasa de formación de la dicloramina es más baja, su máximo se alcanza a pH próximo a 4,5; a pH inferior a 4, fundamentalmente, sólo habrá tricloramina o tricloruro de nitrógeno, por tanto, a los pH normales del tratamiento, próximos a 7-8, la principal cloramina que se encuentra presente es la monocloramina, mientras que la dicloramina no representará un porcentaje significativo en el total, a menos que la relación molar cloro/amoníaco sea mayor que 1 y menos aún la tricloramina.
Conocido el caso de la cloración por el punto crítico o breakpoint y trasladando esta técnica al caso hipotético de un agua que sólo contenga amoníaco, todos los compuestos formados en la cloración serán cloraminas.
Las reacciones de óxido-reducción del amoníaco y el cloro existen en el sentido de oxidación del amoníaco y reducción del cloro. Cuando la relación molar de cloro a amoníaco alcanza el valor de 2/1, el proceso es prácticamente completo, desapareciendo tanto el amoníaco como el cloro oxidante. Este punto es conocido como punto de inflexión de estas reacciones y se corresponde al punto de breakpoint para la cloración de un agua natural o residual, como ya se ha señalado.
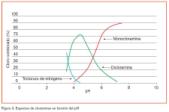
En la figura 4 se representa la gráfica teórica de estas reacciones y en ella se aprecia que entre los puntos A y B la relación molar de cloro a amoníaco es menor que 1 y el cloro que ha reaccionado con el amoníaco pasa a formar casi totalmente monocloramina, máxima en el punto B (relación molar cloro/amoníaco igual a 1). Al pasar del punto B, las monocloraminas van pasando a dicloraminas y tricloraminas hasta llegar al punto de inflexión (relación molar cloro/amoníaco igual a 2,1, equivalente aproximadamente a una relación en peso igual a 8) donde las cloraminas habrán sido destruidas (en este punto existirá una pequeña cantidad de cloro residual irreducible, formando pequeñas cantidades de tricloraminas). A partir del punto de inflexión, el cloro que se siga añadiendo quedará en forma de cloro residual libre y la monocloramina habrá pasado a nitrógeno gas, según la siguiente reacción:
2 ClNH2 + ClOH = N2 + 3ClH + H2O
La evolución del amoníaco en la formación de las cloraminas puede seguirse en el mismo gráfico, donde partiendo de una concentración determinada (en el gráfico 0,5 mg/l), pasa completamente a monocloramina cuando la relación molar cloro/amoníaco es igual a 1 (aproximadamente 4/1 en peso). Si no se ha alcanzado esta relación, existirá amoníaco libre junto al combinado. Las cantidades de uno y otro para una dosis de cloro añadido vienen determinadas por la recta AB.
Para la mayoría de las aguas superficiales, la representación gráfica que nos indica la evolución del cloro residual, a medida que se va aplicando cloro, es diferente y menos acusada que la antes expuesta para un agua con sólo amoníaco.
En la figura 5 se representan las zonas de formación de las distintas cloraminas, expresando las concentraciones de cloro residual y cloro añadido en mg por mg de amonio.
En la formación de cloraminas, mediante reacción del cloro y amoníaco, la relación óptima cloro/amoníaco más aceptada para la formación de monocloraminas, es 4/1 en peso. A su vez, la monocloramina, originará menos problemas de sabores y olores que la di y tricloramina, que se formarán a más altas relaciones cloro/amoníaco o más bajos pH. La dicloramina a concentraciones del orden de 0,5 mg/l puede ocasionar problemas de sabores y olores. En el caso de la tricloramina, su presencia, aun a concentraciones tan bajas como 0,02 mg/l, comunica un olor irritante y junto con la dicloramina es la responsable del clásico “olor a interior de piscina”. Ambas se desprenden del agua a una velocidad superior a la monocloramina, especialmente la tricloramina.
La capacidad bactericida de las cloraminas es atribuida al grado de hidrólisis de éstas y también a la propia cloramina no hidrolizada. La pequeña constante de hidrólisis de las cloraminas sólo permite la formación de una pequeña cantidad de ácido hipocloroso, pero a medida que éste desaparece, la hidrólisis continúa de la cloramina proporciona más ácido hipocloroso y amoníaco. La hidrólisis viene representada por la reacción:
ClNH2 + H2O = ClOH + NH3
Según la AWWA, las cloraminas eran, en 1998, el segundo desinfectante de agua más empleado. Cerca del 30 % de abastecimientos medios y grandes de EEUU las emplean.
En Estados Unidos, dadas las más restrictivas limitaciones para la formación de subproductos de desinfección, son muchas las instalaciones de tratamiento de agua que están volviendo a la desinfección con cloraminas. La propia USEPA sugiere el empleo de cloraminas para reducir los THMs totales, llegando a medirse reducciones de entre el 40% y el 80% (los ácidos haloacéticos no son reducidos tan considerablemente.
Es en Estados Unidos y Canadá donde más extendido está el uso de cloraminas. Abastecimientos importantes como Dallas, Denver, St. Louis, Orleans, Indianapolis, Milwaukee, Miami, Portland, Philadelphia, San Francisco y otros muchos, emplean cloraminas desde hace años. En la actualidad siguen implantando la cloraminación con objeto de reducir la formación de THMs. Los abastecimientos que cambian e implantan la cloraminación como cloro residual en la red, realizan campañas de comunicación de este cambio, informando a los consumidores acerca de qué son las cloraminas y algunas medidas a tomar en casos concretos.
En Europa no está muy extendido su empleo, siendo Madrid uno de los principales sistemas de abastecimiento que las utiliza como desinfectante secundario en la red, desde hace 35 años.
Considerando que la Directiva de la UE limita el contenido de amoníaco a un máximo de 0,5 mg/l, y admitiendo que el amoníaco que se encuentra combinado para formar las cloraminas y añadido expresamente con este fin está sometido a esta limitación, el contenido máximo de cloraminas (monocloramina) para una relación cloro/amoníaco en peso de 4/1 será de 2 mg/l, que por otra parte es el máximo contenido de cloro residual combinado permitido por nuestra reciente reglamentación. La concentración a aplicar sería específica de cada abastecimiento, es decir, variaría en función de su extensión, tiempo de retención, evolución y demanda del propio sistema. La OMS fija un nivel guía para el amoníaco de 1,5 mg/l y una dosis en la aplicación de cloraminas de 3 mg/l.
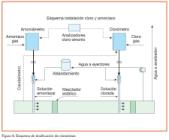
En la figura 6 se representa el esquema de una instalación de dosificación de cloro y amoníaco para la formación de cloramina.
Evolución de las cloraminas en el tiempo y con el pH
La temperatura, como en los demás desinfectantes, contribuye a una mayor eficacia de las cloraminas como desinfectante. En conjunto, la eficiencia disminuye al aumentar el pH y bajar la temperatura (aunque la degradación o disociación de la cloramina con el tiempo es menor al aumentar el pH, como se aprecia en la figura 7). En ensayos realizados para inactivación de E. Coli y poliovirus, por Wolfe, Delly y otros, se comprobó una inactivación 60 veces menor a pH 9,5 y temperatura entre 2 y 6 ºC que a pH 7 y temperatura entre 20 y 25 ºC.
Se ha indicado anteriormente que la velocidad de formación de la monocloramina es rápida y muy sensible al pH; en la siguiente tabla se muestra ,para una conversión al 99% de cloro en cloramina, los tiempos de reacción calculados a una temperatura de 25 ºC y para una relación cloro/amoníaco 3/1 (White 1992).

A medida que la cloramina se va degradando, mayor es la concentración de amoníaco libre que podrá ser transformado en nitritos por la presencia de bacterias nitrificantes (nitrosomonas). En el hipotético caso de que toda la cloramina, en su hidrólisis, quedara final-mente como amoníaco, podría volver a reclorarse y formarse de nuevo cloraminas, pero esta situación prácticamente no se da. A tal efecto exponemos diversos ensayos que hemos realizado con diferentes aguas tratadas, partiendo de una concentración inicial de cloro combinado (monocloramina) de 1,8 mg/l y 0,45 mg/l de amoníaco y midiendo a lo largo del tiempo los contenidos tanto de cloro combinado como de amoníaco total (libre más combinado). Al cabo de 250 horas, el contenido de cloro combinado (como media de tres ensayos), había decaído hasta quedar en 0,48 mg/l, mientras que el amoníaco total era 0,41mg/l (es decir, prácticamente el inicial). Considerando que aproximadamente los 0,48 mg/l de cloro combinado lo eran con 0,12 mg/l de NH3, el resto de amoníaco, es decir, 0,41 – 0,12 = 0,29 mg/l estaría en disposición de volver a formar cloramina. Se añadió entonces 1,20 mg/l de cloro libre (mediante hipoclorito sódico) y al cabo de 30 minutos se determinó el cloro combinado (monocloramina), resultando ser 1,62 mg/l; es decir, hemos vuelto a generar monocloramina al añadir el cloro indicado en la relación cloro/amoníaco 4/1, junto a la que aún permanecía (0,48 mg/l); la pequeña cantidad (0,06 mg/l) que en el balance nos falta, sobre los 1,68 mg/l (0,48 + 1,20), puede atribuirse a la destrucción de una mínima cantidad de los 0,48 mg/l de la cloramina residual inicial al incorporar los 1,20 mg/l de cloro libre. Hay que señalar que estos ensayos han sido realizados en laboratorio, donde no existen los posibles efectos de nitrificación que pueden darse en la red.
El tiempo que transcurre en la degradación de la monocloramina es suficientemente largo, por lo que puede mantenerse una concentración aceptable en puntos alejados de la red. En la figura 7se muestran varias curvas donde se refleja la evolución del cloro residual al pasar el tiempo, en un agua tratada con monocloramina (como desinfectante secundario o postdesinfección) a dos temperaturas distintas y en un agua tratada con cloro libre, en ambos casos a escala de laboratorio. Puede observarse la mayor estabilidad dada por la mayor permanencia del cloro residual combinado respecto del cloro libre.
La velocidad de disociación de las cloraminas está influenciada también por el pH; así, por ejemplo, en el rango de pH de 7 a 9 la monocloramina se disocia en mayor grado en amoníaco al pH más bajo, y pueden por tanto aparecer fenómenos de nitrificación más fácilmente. En la figura 8 se muestra esta evolución al someter dos muestras de agua tratada a la misma temperatura (17 ºC) y distinto pH, tomadas a la salida de una ETAP.
La evolución y disminución del cloro combinado en la red, dentro de un extenso sistema de abastecimiento (8.000 km de red) desde la salida del agua en la estación de tratamiento hasta los puntos más alejados de ésta, con unos tiempos transcurridos del orden de 72 a 96 horas, e incluso mayores, está en torno al 20% (concentraciones de cloro combinado a la salida de las estaciones de tratamiento entre 1,8 y 2,0 mg/l quedan reducidas a concentraciones del orden de 1,5 mg/l al llegar a los últimos consumidores).
Poder oxidante y desinfectante de las cloraminas
El cloro residual combinado (cloraminas) tiene menor poder oxidante y bactericida que el cloro residual libre (ClOH y ClO–), como muestra la tabla 3. En ella se compara la concentración de cloro residual libre después de un tiempo de contacto de 10 minutos, con la concentración de cloro residual combinado (cloraminas), después de un tiempo de contacto de 60 minutos a diferentes valores de pH, para lograr una efectiva desinfección.
Aun cuando el poder desinfectante de las cloraminas es menor que el del cloro libre, en cambio son más estables que éste a igual tiempo de contacto, pH y temperatura. Por eso el cloro residual combinado que se encuentre en un agua formando las cloraminas es más persistente, siendo este el motivo principal por el cual se las empezó a utilizar incorporando expresamente amoníaco al agua, sobre todo en conducciones largas y redes de distribución extensas, como fase final del proceso de tratamiento, después de haber estado un cierto tiempo de contacto el agua con cloro libre. En estas circunstancias se habrán formado THMs dentro de la planta de tratamiento, a no ser que se utilice como desinfectante principal otro distinto al cloro, como por ejemplo el dióxido de cloro, de modo que con la formación de cloraminas a la salida de la planta lo que se pretende es detener la formación de THMs en la red.
El poder o eficiencia bactericida de las cloraminas, en relación con los desinfectantes generalmente empleados en el tratamiento del agua, dentro de los límites de pH más frecuentes ( pH = 6 a pH = 9), quedaría reflejado en el siguiente orden:
Ozono > Dióxido de cloro > Cloro
libre > Cloraminas
Por el contrario, en cuanto a estabilidad y persistencia en la red de distribución el orden es distinto, figurando en el primer término de la relación:
Cloraminas > Dióxido de
cloro > Cloro libre > Ozono
En cuanto a las reacciones del cloro con el amoníaco, hemos de añadir a lo expuesto que en el agua pueden encontrarse compuestos amoniacales y compuestos de nitrógeno orgánico.
Estos compuestos de nitrógeno orgánico al reaccionar con el cloro dan aminas cloradas. Las más simples serían del tipo de la cloro metilamina o de la diclorometilamina:
CH3NH2 + ClOH = CH3NHCl (clorometilamina) + H2O CH3NHCl + ClOH = CH3NHCl2 (diclorometilamina) + H2O
que no deben confundirse con las cloraminas que venimos comentando en el proceso de desinfección del agua. Las cloraminas formadas en función del contenido de nitrógeno orgánico y amoniacal de la fuente del agua son realmente en sí mismas un subproducto de la cloración.
La formación de hidroxilamina a partir de dicloramina, si tuviese lugar, lo hace a una velocidad muy lenta, no ocurriendo en el tiempo que el agua permanece normalmente en un sistema de abastecimiento.
Las propias cloraminas inorgánicas pueden reaccionar lentamente con aminas orgánicas para formar cloraminas orgánicas y amoníaco:
ClNH2 + RNH2 = NH 3 + RNHCl
Esta transferencia de cloro de la monocloramina a las aminas orgánicas para formar cloraminas orgánicas se atribuye a la lenta hidrólisis de la monocloramina en amonio y cloro. De igual forma, la oxidación de distintas materias orgánicas por cloraminas da lugar a la formación de amoníaco.
Son muchas las investigaciones que han puesto de manifiesto el buen comportamiento de las cloraminas en el control de sabores y olores, control del recrecimiento microbiológico en la red, mayor estabilidad y mantenimiento de desinfectante residual a lo largo de la red de abastecimiento que el cloro libre y menor cantidad de THMs formados.
Las cloraminas son menos oxidantes y desinfectantes que el cloro libre y, por tanto, no muy indicadas para emplearlas como desinfectante primario o principal.
Puede resumirse que las cloraminas sólo deben emplearse como desinfectante secundario y como protección contra recrecimientos microbiológicos en la red especialmente si no se tiene conseguido un sistema de abastecimiento biológicamente estable. Es más caro conseguir un abastecimiento estable a base de un tratamiento del agua completo y amplio incluyendo filtros de carbón, junto a una óptima y eficaz gestión de la red, que emplear cloro o cloramina para controlar el recrecimiento microbiológico en la red.
Las cloraminas y la formación de trihalometanos en la red
Una vez que el agua ha salido de una planta de tratamiento con una determinada concentración de cloro libre residual ( circunstancia ésta muy extendida en la mayoría de los abastecimientos de agua), este cloro residual tiene la capacidad potencial de seguir formando subproductos, como los trihalometanos, ya que en la propia red y en su biofilm puede encontrarse materia orgánica susceptible de formar estos subproductos. Si el cloro residual que llega a la red lo es, en cambio, en forma de cloraminas, la formación de estos trihalometanos se vería minimizada.
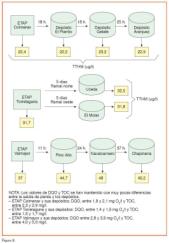
Este hecho ha sido ampliamente comprobado en el sistema de abastecimiento de Madrid en aguas tratadas con cloraminas, a la salida de distintas ETAPs y en depósitos del sistema de abastecimiento correspondientes y sucesivos a cada una de estas ETAPs. En general, puede concluirse que el aumento en la concentración de THMs en estos depósitos con respecto a la salida de las ETAPs es mínimo en todos los casos, con tiempos de retención en algunos del orden de cinco días (figura 9).
Asimismo en ensayos comparativos con agua tratada a la salida de varias ETAPs, en unos casos con cloro libre y en otros con cloro combinado, en lo que podemos considerar como formación potencial de THMs o como formación de THM en sistemas de distribución simulada, se observan claramente los mayores contenidos en THM en las muestras correspondientes al agua tratada con cloro libre que en las del agua tratada con cloro combinado (incrementos mayores al 100% cuando se emplea cloro libre en lugar de cloraminas).
En la tabla 4 se recogen estas diferentes concentraciones de trihalometanos para el caso concreto de dos ETAPs
Ventajas y desventajas del uso de las cloraminas
Ventajas
Entre las ventajas del empleo de las cloraminas como desinfectante secundario pueden destacarse las siguientes:
- No reaccionan con los compuestos orgánicos como lo hace el cloro libre en la formación de los THMs, pero en cambio no reduce en el mismo grado la formación de ácidos haloacéticos.
- Son muy efectivas en el control del biofilm, dada su gran capacidad de penetración en el interior de este biofilm.
- Al no reaccionar con los compuestos orgánicos en el mismo grado que lo hace el cloro, se pueden disminuir algunos olores y sabores que el cloro libre podría llegar a potenciar, disminuyendo las quejas de los consumidores.
- Son más estables y de más duración como residual que el cloro libre o el dióxido de cloro, con lo cual proporciona una mejor protección contra el recrecimiento bacteriano en los grandes abastecimientos y redes con zonas de excesivo tiempo de retención (presenta un buen efecto bacteriostático).
- Su preparación es fácil.
- Evita generalmente la instalación de estaciones de recloración en algunos abastecimientos extensos y en épocas de mayores temperaturas.
Desventajas
Entre las desventajas deben destacarse las siguientes:
- Nitrificación. Es uno de los principales problemas que pueden presentarse al emplear cloraminas, ya que el amoníaco en exceso al requerido para formar la cloramina, a veces generado en la descomposición de esta en puntos muertos de la red o en lugares de excesivo tiempo de retención, actúa como nutriente de las bacterias nitrificantes, que converti-rán este amoníaco en nitritos y nitratos con los efectos adversos que éstos pueden ocasionar para la salud y la consiguiente pérdida de cloro.
- Las condiciones más favorables para la nitrificación se darán cuando la relación cloro/amoníaco sea baja (menor de 3), el pH sea bajo (las cloraminas se disocian más fácilmente a pH 7 que a pH 9), exista amoníaco libre, los contenidos de sustancias orgánicas en el agua y los tiempos de retención en la red sean altos, las temperaturas del agua elevadas (mayo-res de 20 ºC), ausencia de luz y oxígeno, tuberculaciones en las tuberías, biofilm y sedimentos. En lugares con temperaturas del agua superiores a 15 ºC y en los que el agua contenga cloraminas, es conveniente una monitorización continua del agua para controlar el posible riesgo de nitrificación. La aparición de nitritos reduce el pH, la alcalinidad, el oxígeno disuelto y la propia concentración de cloramina residual, incrementándose el recrecimiento bacteriano. La pérdida de cloramina residual es un indicador de que pueden estar ocurriendo fenómenos de nitrificación en el sistema de abastecimiento.
- Menor capacidad de oxidación y desinfección. Tienen menor capacidad de desinfección que el cloro, dióxido de cloro y ozono. No oxidan a ciertas sustancias frecuentes en muchas aguas como son el hierro, manganeso y sulfuros.
- Generan algunos otros subproductos en menores cantidades, aunque concretamente se cita que alguno, como por ejemplo el cloruro de cianógeno, podría formarse en más altas concentraciones.
- Hay que prepararlas generalmente in situ
- Finalmente, hay que indicar que si se emplean las aguas que contienen cloraminas en tratamientos de diálisis en enfermos renales, hay que eliminarlas previamente a su entrada a los equipos dializadores, al igual que es necesario hacer con el cloro, y en actividades piscícolas y acuarios. Las cloraminas pueden ser eliminadas filtrando el agua por carbón activo. También son eliminadas mediante la adición de ácido ascórbico. No son eliminadas por procedimientos tales como: hervir el agua, destilarla, ósmosis inversa o dejar el agua en reposo uno o dos días.
Información toxicológica
La información sobre el metabolismo de las cloraminas es muy limitada. Son eliminadas en cierta cantidad por la orina. Experimentos realizados a corto plazo no han mostrado efectos hematológicos adversos en ratas, ratones y monos sometidos durante 6 semanas a beber agua con
100 mg/l de monocloramina. En otros experimentos, relatados por la EPA, fue administrada a ratas y ratones monocloramina en el agua de bebida, a unas concentraciones de 0,25, 50, 100, 200 y
400 mg/l, durante 91 días, observándose daño en el hígado de las ratas cuando las dosis eran de 200 y 400 mg/l y en los ratones para las dosis de 100, 200 y 400 mg/l. También se observaron ligeras alteraciones citológicas en el hígado de ratones a los que se administró 200 y 400 mg/l
de cloraminas. Observaciones microscópicas en los tejidos de las ratas sometidas a 400 mg/l de cloramina no revelaron ninguna lesión relacionada. Se sugirió un NOEL (no-observed-effect level) de 50 mg/l, o bien 8,3 mg/kg/día de monocloramina, basándose en las inflamaciones crónicas del hígado en ratones.
Organismos y guías internacionales sobre calidad del agua potable no asocian efectos en la salud, ni a corto ni a largo plazo, con las cloraminas del agua. Hasta la fecha, la Iternational Agency for Research on Cancer (IARC) no ha evaluado formalmente la potencial carcinogenicidad de las cloraminas.
La concentración máxima en el agua de 3 mg/l cloraminas, recomendada por la OMS, se basa en una “ingestión tolerable diaria” (TDI) de monocloramina de 94 mg/kg de peso del cuerpo, derivado a su vez de un “no observado nivel de efecto adverso” (NOAEL), de 9,4 mg/kg de peso del cuerpo, dividido por un factor de seguridad de 100.
Conclusiones
El empleo de cloraminas como desinfectante alternativo al cloro para reducir la formación de subproductos tales como los trihalometanos, a la vez que se aprovecha la mayor estabilidad que la del cloro libre, es una práctica de desinfección del agua aplicada en distintos abastecimientos.
El empleo de las cloraminas como desinfectante secundario para mantener una concentración estable y constante en toda la red de abastecimiento, evitando las recloraciones y a su vez consiguiendo un menor incremento y formación de trihalometanos en la red, una vez que el agua ha salido de la planta de tratamiento, es una práctica a tener en cuenta. Se puede cumplir así con los requerimientos cada vez más restrictivos de las distintas reglamentaciones.
El empleo de las cloraminas como desinfectante secundario implica la aplicación previa del desinfectante primario o inicial que puede ser, generalmente, el propio cloro libre, ozono o dióxido de cloro, ya que, como se indica en esta exposición, el menor poder oxidante y bactericida de las cloraminas y las concentraciones y tiempos de contacto que requieren son tales que las hacen inapropiadas para emplearlas como desinfectante primario o principal.
El Canal de Isabel II es posiblemente el mayor abastecimiento europeo que emplea cloraminas desde hace 35 años. En EEUU, Canadá y Australia son más utilizadas que en Europa.
Bibliografía
Ramírez Quirós, Francisco. La reglamentación sobre desinfección del agua. Mantenimiento del cloro residual en la red. Cloraminas. Revista de Ingeniería Municipal, p. 39-48. Febrero 2001
United States Environmental Protection Agency (USEPA). Characterizing the Effect of Chlorine and Chloramines on Formation of Biofilm in a Simulated Drinking Water Distribution System. EPA/600/R01/024. Sep. 1999.
D.G. Neden, R.J. Jones, J.R. Smith, G.J. Kirmeyer and G. W. Foust. Comparing Chlorination for Controlling Bacterial Regrowth. Journal AWWA, 84 (7): 80 (1992).
J.L. Kool, J.C. Carpenter y B.Stield. Effect of monochloramine disinfection of municipal drinking water on risk of nosocomial Legionnaires disease. The Lancet (1999) 353 p. 272-7.
G.J. Kirmeyer y otros. Optimizing Chloramine Treatment. AWWA Research Foundation and AWWA. Denver, Colorado, 1993.
Shin-Ichi Tokuno and Floyd Baker. The Effect of Nitrification on Sampling Sites. WATER/Engineering & Management, Nov. 1997.
Carolyn L. Smallwood y otros. Drinking Water Criteria Document for Chloramines. U.S. Environmental Protection Agency. Aug. 1994.